Screening of blood-brain barrier permeable near-infrared ratiometric fluorogenic probe for non-invasive tracking of peroxynitrite during neuroinflammation and Alzheimer's disease progression
,
,
,
,
,
,
- a
- Key Laboratory of Haikou Trauma, Key Laboratory of Hainan Trauma and Disaster Rescue, Key Laboratory of Emergency and Trauma of Ministry of Education, Department of Ophthalmology, The First Affiliated Hospital of Hainan Medical University, Hainan Medical University, Haikou 571199, China
- b
- Engineering Research Centre for Hainan Bio-Smart Materials and Bio-Medical Devices, Key Laboratory of Hainan Functional Materials and Molecular Imaging, College of Emergency and Trauma, Hainan Medical University, Haikou 571199, China
Received 15 April 2025, Revised 16 June 2025, Accepted 5 July 2025, Available online 6 July 2025, Version of Record 8 July 2025.
Highlights
•
The newly screened NIRF probe TCFC-F crossed the BBB and enabled precise detection of ONOO- in the brain.
•
TCFC-F allowed dynamic tracking of ONOO- during neuroinflammation and Alzheimer's disease progression.
•
TCFC-F visualized AGR’s neuroprotective in vivo, offering a valuable tool for therapeutic evaluation in neurodegenerative diseases.
Abstract
Excessive production of reactive oxygen species (ROS) is a critical mechanism in the pathogenesis of neuroinflammation and Alzheimer's disease (AD). Peroxynitrite (ONOO−), in particular, is capable of oxidizing lipids, proteins, and DNA, leading to the destruction of cellular structure and function, and is considered a key marker of nerve injury. Therefore, the design of innovative fluorogenic probes for imaging ONOO− could contribute to a deeper understanding of neuroinflammation and AD pathogenesis, as well as aid in the development of early diagnostic and therapeutic strategies. In this work, we identified TCFC-F, a near-infrared fluorogenic (NIRF) probe based on trifluoromethyl coumarin dye with excellent blood-brain barrier (BBB) permeability, for the detection of ONOO−. Of the synthesized NIRF probes, only TCFC-F exhibited strong anti-interference capability, with the other three showing varying degrees of response to cysteine (Cys), glutathione (GSH), hydrogen sulfide (H2S), and sulfur dioxide (SO2). In PC12 cell models, TCFC-F demonstrated excellent ratiometric fluorescence response to exogenous and endogenous ONOO−. In a mouse model of lipopolysaccharide (LPS)-induced neuroinflammation, TCFC-F distinguished between different levels of inflammation induced by varying doses of LPS and provided visual evidence of the neuroprotective effect of arctigenin (ARG). Finally, TCFC-F was successfully applied to dynamically monitor ONOO− levels in the brains of AD mice at different ages, revealing a positive correlation between ONOO− expression and disease progression. These findings demonstrate that TCFC-F is a highly sensitive and selective NIRF probe, suitable for the detection of ONOO− both in vitro and in vivo and is a promising tool for studying neurodegenerative diseases.
炎症是机体针对损伤或感染的一种防御机制。 轻度的神经炎症有助于清除细胞碎片和衰老神经元,维持大脑的代谢平衡。然而,炎症反应的过度激活会损伤神经元和脑组织。 由于神经元不可再生,慢性神经炎症可导致不可逆的神经元损伤,最终引发神经退行性疾病。阿尔茨海默病(AD)是中枢神经系统退行性疾病的典型代表,主要影响老年人,其特征为记忆力下降、认知功能障碍和行为异常。AD目前无法治愈,现有治疗仅能缓解症状并延缓疾病进展。 AD的病理特征包括β-淀粉样斑块和tau蛋白缠结,这些病理变化会触发小胶质细胞和星形胶质细胞的过度激活,释放炎症因子,从而加剧神经元损伤。此外,神经炎症通过诱导氧化应激和破坏血脑屏障(BBB),在驱动AD进展中发挥着关键作用。过氧亚硝酸盐(ONOO⁻) 由一氧化氮(NO)与超氧阴离子(O₂•⁻)反应生成,参与氧化应激和神经炎症过程,并被证实是AD及其他神经系统疾病的重要标志物。 ONOO⁻ 通过硝化和氧化反应直接损伤DNA、脂质和蛋白质等生物分子,破坏线粒体功能并损害突触信号传递,从而加速神经退行性过程。
近红外荧光(NIRF)成像技术 因其优异的组织穿透能力和低背景干扰,在研究 ONOO⁻ 相关疾病方面具有显著优势。尽管目前已经开发出一些用于神经系统疾病的 ONOO⁻ 荧光探针,但其在血脑屏障(BBB)通透性、组织穿透深度以及抗干扰能力方面的局限性,阻碍了它们的临床应用。因此,亟需开发具有高选择性、深层组织成像能力和有效血脑屏障通透性的 ONOO⁻ 探针,以推进其在神经退行性疾病诊断中的应用。
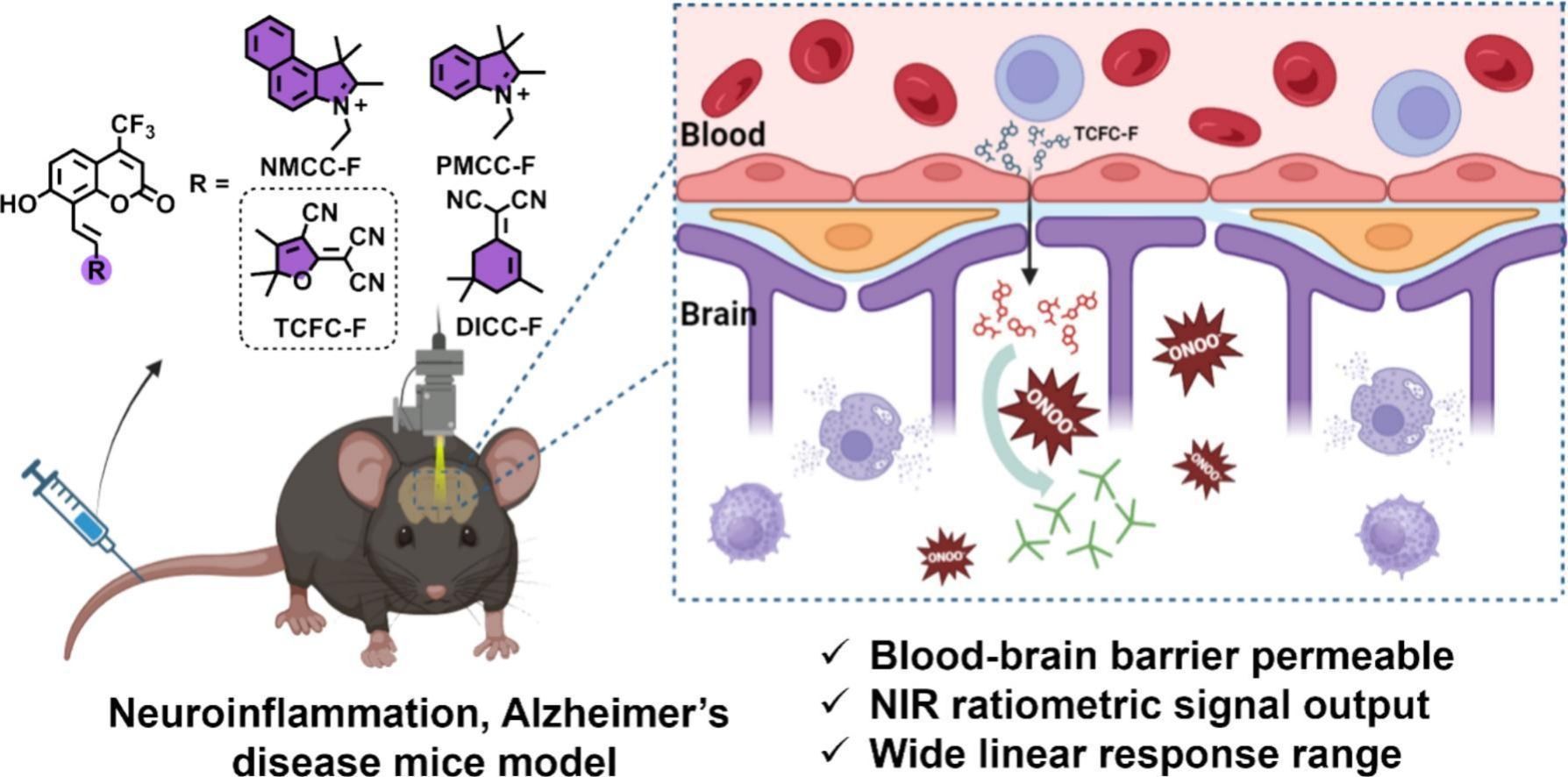
牛蒡子苷元(ARG) 是一种从牛蒡(Arctium lappa)中提取的木脂素化合物,具有良好的抗炎和神经保护活性。研究表明,它能够穿越血脑屏障并调节氧化应激相关通路,在神经退行性疾病中展现出潜在的治疗价值。在本研究中,作者筛选出了 TCFC-F,这是一种具有最佳亲水亲油平衡性的近红外荧光(NIRF)探针(方案 1)。TCFC-F 具有优异的血脑屏障(BBB)通透性和高选择性,能够特异性检测 ONOO⁻。 TCFC-F 的关键特性包括:结构中引入三氟甲基,确保高效的血脑屏障通透性;发射波长位于近红外窗口,增强组织穿透能力;消除常见活性硫/氧物种的干扰,提供高特异性;比率型荧光发射,最大程度减少环境影响,提高检测准确性。值得注意的是,TCFC-F 能够动态监测活细胞、脂多糖(LPS)诱导的神经炎症模型以及阿尔茨海默病(AD)小鼠模型中的 ONOO⁻ 水平。最重要的是,TCFC-F 首次被用于可视化牛蒡子苷元(ARG)的神经保护作用。这项研究为神经炎症和神经退行性疾病的早期诊断与治疗提供了一种新工具。
方案1. 神经炎症和阿尔茨海默病中ONOO-的BBB可渗透近红外比率荧光探针示意图(由BioRender提供)。
图1.(a)基于4-三氟甲基香豆素染料的ONOO-近红外荧光探针的设计策略。(b)添加常见的生物亲核物质(ONOO-、Cys、GSH、H2S和SO2)后,NMCC-F、PMCC-F、DCIC-F和TCFC-F的荧光值。ONOO−,100μM;Cys,200μM;GSH,1 mM;H2S,100μM;二氧化硫,80μM。λex=488nm。
图2. TCFC-F(10μM)的光谱数据。(a)存在或不存在ONOO-(110μM)时TCFC-F的吸收光谱。(b)TCFC-F对不同浓度ONOO-(0-110μM)的荧光光谱,激发波长为488 nm(b)和580 nm(c)。(d)添加ONOO-(110μM)前后TCFC-F的随时间变化的发射比(F550 nm/F665 nm)。(e)pH值对有或没有ONOO-(110μM)的发射比(F550 nm/F665 nm)的影响。(f)TCFC-f对各种分析物的特异性(100μM的Ca2+、Fe2+、K+、Cu2+、Mg2+、Co2+、Zn2+、PO4 3−、NO2−、HS−、80μM的HSO3−、200μM的Cys、1 mM的GSH、100μM的H2O2、O2.-、O2 1、HOCl、.OH、110μM的ONOO-)。λex=488nm。数据表示为平均值±标准差(n=3)。
图3.(a)PC12细胞中外源性ONOO-的荧光成像。将细胞与不同剂量的SIN-1(0.0、0.5、1.0 mM)或SIN-1在AG(1.0 mM)存在下孵育2小时,然后与CTAB(50μM,10分钟)孵育,然后与TCFC-F(10μM)孵育30分钟。(b)PC12细胞内源性ONOO-的荧光成像。PC12细胞用LPS(0.0、1.0或2.0μg/mL)或LPS(2.0μg/mL)+IFN-γ(100 ng/mL)处理12小时,可加或不加NAC(1 mM)。然后用PMA(10 nM,30分钟)、CTAB(50μM,10分钟)和TCFC-F(10μM,30分钟)孵育细胞。比例尺:20μm。
图4. Aβ42诱导的AD细胞模型中ONOO-的荧光成像。(a)细胞与aβ42(30μM)一起培养0、12、24、48小时,与50μM CTAB一起培养10分钟,然后与TCFC-F(10μM)孵育30分钟。(b)TCFC-F标记细胞在平面(a)中的比率(绿/红)荧光强度。数据为平均值±标准差(n=3)。比例尺:20μm。
图5.(a)LPS诱导的神经炎症模型中ONOO-的体内成像示意图。(b)来自WT、L-LPS、H-LPS、LPS+ARG组的体内荧光成像(10、20、30分钟)。(c)图(b)中小鼠离体器官的荧光图像:肺、肝、脾、肾、心脏、脑。(d)脑组织切片的H&E染色。比例尺:150μm。图(b)中绿色(e)和红色通道(f)的平均荧光强度的定量。(g,h)炎症因子IL-1β和TNF-α的组织水平。数据为平均值±标准差(n=3)。使用单因素方差分析和显著差异的多重比较检验进行统计分析。
图6.(a)阿尔茨海默病模型中ONOO-的体内成像示意图。(b)来自WT、3个月、6个月和9个月AD组的体内荧光成像(15、30分钟)。图(b)中绿色(c)和红色通道(d)的平均荧光强度的定量。(e)不同年龄(3、6、9个月)的WT和AD小鼠脑组织切片的H&E染色。比例尺:150μm。
总之,作者通过分子优化开发了一种新型的 D-π-A 共轭近红外荧光(NIRF)探针 TCFC-F,该探针能够特异性检测 ONOO⁻。 与本研究中合成的其他三种三氟甲基香豆素衍生物相比,TCFC-F 展现出更优异的选择性和抗干扰能力,特别是在存在常见活性硫物种(如 Cys、GSH、H₂S 和 SO₂)时,其荧光响应仍能保持稳定。最重要的是,得益于其良好的亲脂性,作者在脂多糖(LPS)诱导的神经炎症模型中成功证明:牛蒡子苷元(ARG)通过降低 ONOO⁻ 水平显著改善了氧化应激,从而提供了有效的神经保护作用。值得注意的是,在阿尔茨海默病(AD)模型中,TCFC-F 能够准确追踪小鼠大脑中不同疾病阶段的 ONOO⁻ 变化,反映了 AD 的进展过程。 这证实了该 NIRF 探针在神经退行性疾病中的诊断和监测能力。作者预期 TCFC-F 将成为研究神经炎症和 AD 的有力工具,并可能推动神经学研究领域的进展。
文献链接:https://doi.org/10.1016/j.cej.2025.165720

