
Photoactivation of Boronic Acid Prodrugs via a Phenyl Radical Mechanism: Iridium(III) Anticancer Complex as an Example
通过苯基自由基机制光激活硼酸前药:以铱 (III) 抗癌复合物为例
Moyi Liu1, Yunli Luo1, Junyu Yan1, Xiaolin Xiong1, Xiwen Xing2 , Jong Seung Kim3 , Taotao Zou1
Journal of the American Chemical Society (IF:15.0) Pub Date:2023-04-26,DOI: 10.1021/jacs.3c00254
主讲人:陈萌森 2024年1月28日
研究进展:
机硼(硼酸/酯)化合物在现代药物化学中获得了广泛的研究兴趣。一般来说,三配位硼是缺电子的,可以与生物大分子形成共价加合物,使硼在药物设计中发挥独特的结构作用;成功的例子包括硼替佐米、他伐波罗和克立硼罗,用于临床治疗不同的疾病。同样重要的是有机硼对某些活性氧的反应性,特别是对H2O2的反应性,因为H2O2在许多类型的肿瘤细胞中过度表达。原则上,大多数生物活性分子都可以根据其羟基或胺基与无踪连接体的官能化作用制成硼酸/酯原药。苯硼酸与H2O2的双分子反应在 pH 值为 7.3 时的反应速率相对较慢。这种反应速率表明,原药活化需要高浓度的H2O2。然而,鉴于肿瘤内H2O2的异质性分布和抗氧化系统的上调,内源性H2O2可能并不总是足够的。然而,开发一种时空可控的通用有机硼原药活化方法仍是一项巨大挑战。
光诱导前药激活是疾病组织时空分辨率的最有效的策略之一。基于金属配合物的前体药物由于其丰富的光化学性质而迅速发展起来。确实,含有铂金属离子、钌和其他离子的前药已被报道在局部肿瘤中可以被光催化或光化学激活。鉴于局限性癌症治疗如临床光动力治疗(PDT)的副作用较低,有可能利用周围的O2来帮助前药激活,例如利用I型光敏机制,通过光催化的还原剂将O2还原为超氧自由基阴离子(O2−)以进行有机硼前药激活。然而,已知肿瘤具有氧含量为0.02−2%的缺氧微环境。尽管有报道称 I 型光导疗法受肿瘤缺氧的影响较小,但光化学还原型光敏剂(PS·-)捕获 O2 的反应速率并不稳定,可能无法为硼-药物活化提供足够的活性氧(ROS)。根据文献记载,碳自由基对O2具有极高的反应活性,其速率常数高达 ∼109M-1s-1 ;因此,即使是低浓度的O2也能引发足够快的反应。
本文利用光激活通过单电子转移产生苯自由基的机制可以在缺氧环境中触发硼酸前药激活,解决了ROS激活浓度依赖的难题以及PDT激活氧气依赖的限制和光敏剂捕获O2反应速率不稳定的问题,并且最终实现了红光触发硼酸前药释放出药物分子。
研究内容:
经典的硼酸前药活化途径依赖于肿瘤细胞内源性的过氧化氢,然而即使是在肿瘤细胞中,胞内过氧化氢的浓度仍受到精密调控,使得硼酸前药的活化效率往往较低。近年来,研究者们通过引入能够在胞内产生ROS的基团(如二茂铁),或利用纳米技术包裹ROS诱导剂(如葡萄糖氧化酶)等方式在一定程度上解决了上述问题。然而,目前仍缺乏针对硼酸前药的时空可控性激活策略。芳基硼酸是常见的苯基自由基前体,其在水溶液中能够发生水解并产生硼负离子,后者在光催化剂的存在下能够被氧化并产生具有高反应活性的苯基自由基。受此启发,作者设想是否可以借助类似的过程实现对硼酸前药的光催化激活。
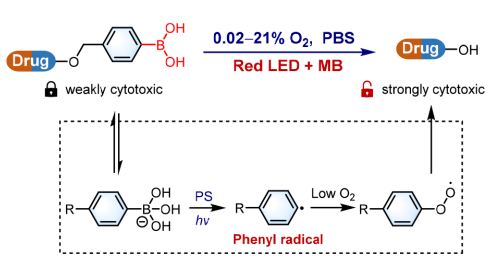
鉴于水溶液中的硼酸与硼酸根阴离子[R-B(OH)3 -]处于平衡状态,而硼酸根阴离子可通过光催化转化为碳自由基(直接淬灭光催化剂的激发态) ,作者设想在缺氧肿瘤微环境下通过苯基碳自由基机制利用光激活硼原药的可能性。有机铱(Ⅲ)配合物具有众所周知的光催化特性,而且其中许多都具有抗癌活性,基于这一事实,作者首先使用含硼酸的 Ir(Ⅲ)配合物 IrBA进行概念验证研究。作者在这里报告说,IrBA 具有合理的稳定性和较低的细胞毒性,但在缺氧条件下进行光照射时,硼分子可以被有效地去除,生成 IrNH2,从而在体外和体内产生强大的抗肿瘤活性。重要的是,这种策略可以扩展到分子间光催化活化,利用外部光敏剂的红色吸收来活化硼笼型临床药物。据我们所知,这是首次发现光诱导苯基自由基机制能有效触发硼药物活化。同时,为了进一步扩展该策略的应用范围,作者选用具有红光吸收性质和较强光氧化能力的亚甲基蓝(MB)作为光催化剂,实现了对模型底物(羟甲基苯硼酸以及羟甲基苯硼酸频那醇脂)、硼酸/硼酸酯-临床药物和IrBA的红光激活。
要点:
1.在不同条件下对IrBA进行光照(420nm),在极低水平的0.1%O2和0.02%O2下无外部还原剂进行实验时,30分钟光照射后,IrBA仍然可以完全转化为IrNH2
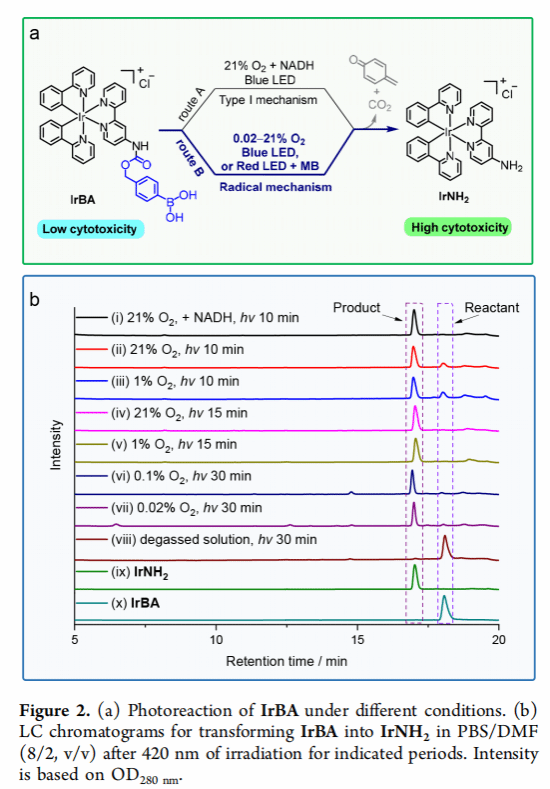
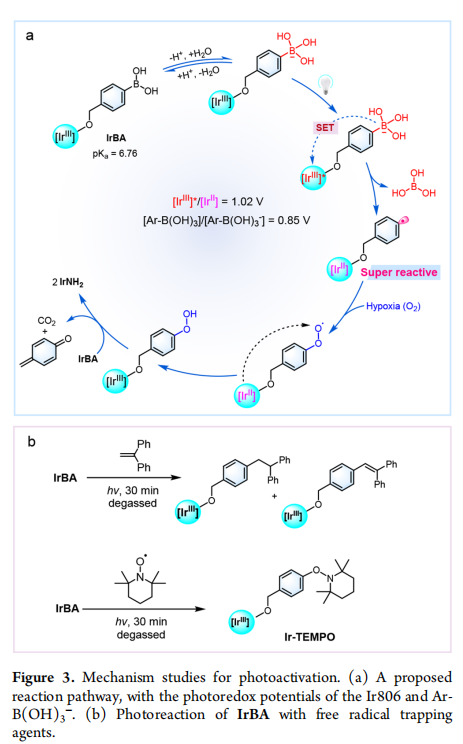
2. 对IrBA光激活的机制进行研究,证明苯基自由基的生成。
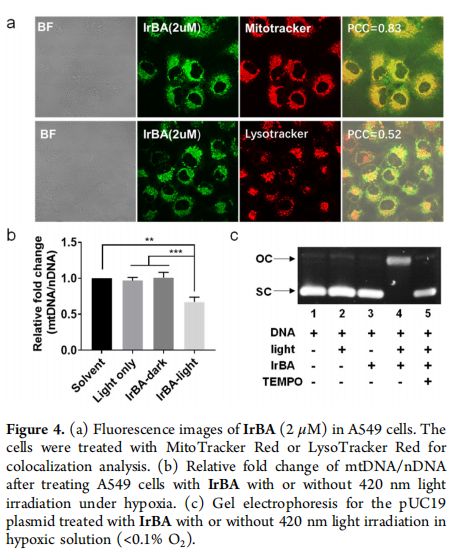
3. 细胞实验中,IrBA与MitoTracker很好地重叠,Pearson相关系数(PCC)为0.83, IrNH2在缺氧条件下可被光化学激活,诱导MMP损失和细胞凋亡。
4.最后,在A549异种移植物的小鼠中经460nm光激活在小鼠体内显示出良好的抗肿瘤活性,在此实验基础上,进一步将IrBA与等摩尔比的亚甲蓝(强光氧化剂)混合, 实现了红光在体内与亚甲蓝联合激活IrBA。
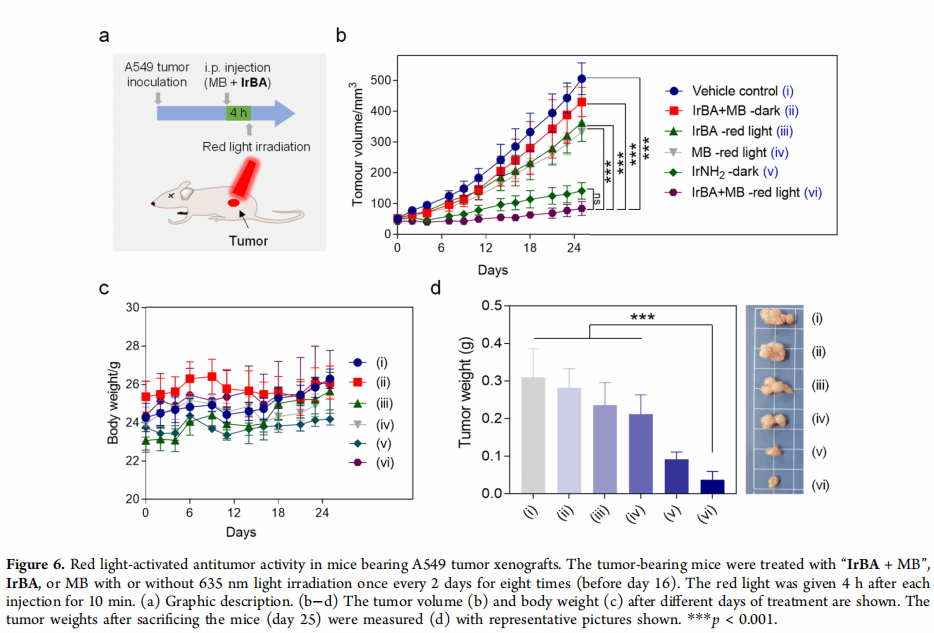
总结与展望:
总之,该课题组已经确定了一种新的硼酸前药的光活化方法。利用环金属化的Ir(Ⅲ)复合物进行的概念验证研究表明,该复合物在缺氧条件下是可光激活的。该复合物在黑暗的细胞条件下显示出合理的稳定性,但可以被可见光照射有效和可控地激活。机理研究表明,活化过程涉及光诱导的单电子转移过程,形成苯基自由基,苯基在相当低的浓度下捕获二氧。因此,光激活过程在缺氧条件下的癌细胞中特别有效,伴随着线粒体DNA损伤、MMP丢失和对不同癌细胞的强细胞毒性。更重要的是,虽然IrBA在黑暗中不能抑制体内肿瘤生长,但光照射显著提高了抗肿瘤活性,但没有引起明显的副作用。自分子间光活化临床红光吸收亚甲基蓝同样在缺氧条件下体外和体内,认为光活化方法可以作为一个通用工具高度时空激活硼前药根除癌症高效但有限的副作用。

