生物成像荧光探针的设计策略与原理
目录
1.1荧光生物成像技术简介
1.2生物成像荧光探针的设计策略与原理.
1.2.1改变π电子体系的范围
1.2.2供电子或吸电子基团取代基效应
1.2.3光诱导电子转移机理
1.2.4光诱导分子内电荷转移..
1.2.5磷光重金属配合物中的电荷转移
1.2.6共振能量转移.
1.2.7稀土配合物的电子能量转移
1.2.8激发态分子内质子转移.
1.2.9激基缔合物和激基复合物.
1.2.10聚集态的荧光发射.
1.2.11 碳氮双键异构化.
1.2.12上转换荧光
1.2.13其他设计理念
1.1荧光生物成像技术简介
荧光生物成像技术(Fluorescence Bioimaging Technology)为亚细胞分辨组织形态学详细信息的可视化研究提供了一种独特的方法,这种技术在操控活体细胞和动物的微活性生物物种领域已经成为一种功能强大的研究辅助工具[1-4]。在荧光生物成像领域荧光探针用来标记感兴趣的分子并呈现出荧光信号。许多新的荧光探针已合成并用于生物成像,包括荧光蛋白、有机染料、金属配合物、半导体纳米晶体、上转换纳米发光材料和其他纳米材料。大部分荧光探针可通过利用高亲和力的抗体抗原相互作用和配体-受体相互作用作为探针监测在活生物样品中生物大分子、阳离子、阴离子、氨基酸和中性小分子[5-22]。荧光分子探针(Fluorescent Molecular Probe)、荧光分子开关(Fluorescent Molecular Switch)和荧光分子传感器(Fluorescent Molecular Sensor)是在荧光分子识别(Fluorescent Molecular Recognition)中经常使用的概念。荧光分子探针是其中内涵最广的一个概念,一般凡是在一定体系内,当某一种物质或体系的某一物理性质发生变化时,该分子的荧光信号能发生相应改变的分子就可称为某一物质或某一物理性质的荧光分子探针。荧光分子开关是指在识别过程中分子荧光信号有明显强弱变化的荧光分子探针。荧光分子传感器是指在识别过程中分子荧光信号能够快速、可逆响应的荧光分子探针。
生物体内存在着各种各样的活性物种(各种蛋白、氨基酸、中性小分子和阴阳离子),例如气体信号调节分子(一氧化氮NO,硫化氢H2S和一氧化碳CO),活性氧物种(ROS,主要包括超氧离子自由基O2-·、过氧化氢H2O2、羟基自由基HO·、脂质氢过氧化物ROOH/ROO·、次氯酸HClO、次溴酸HBrO、过氧化亚硝酰ONOO-、硝酰酸HNO等),还原性物种(例如谷胱甘肽GSH、维生素C、维生素E、尿酸以及各种过氧化物酶等),各种阳离子(例如H+,Na+、K+、Mg2+、Ca2+、Zn2+、Fe2+/3+、Cu+/2+等),各种阴离子(例如Cl-,Br-,HCO3-,HPO42-,SO42-等)。这些活性物种有着特殊的生理功能,并对生命过程起着至关重要的影响,它们的异常变化往往引起某些疾病的发生。它们通过与生物大分子或小分子之间的各种生化反应,参与调控细胞的调亡、变异与分化,支配着生命体系信号转导中重要分子事件的过程和机理。生命体有各种器官构成,各器官所起的生理作用也不同,这些活性物种在各个器官中的相对浓度也不尽相同,在疾病状态下浓度会发生变化。即使在细胞内,各细胞器也有着各自的不同的生理功能,因此这些活性物种在细胞器中存在的种类与浓度也不同。换句话说,这些功能性物种相对聚集的区域与一定的生命活动是紧密地联系在一起的。反之,如果某种功能性物种错误的在某个细胞器聚集或者扩散,那么就会干扰正常的细胞信号转导,从而引起疾病。而且常常是同一种活性物种在不同的细胞区域所起的生理功能也是不相同的。这些活性物种之间也有着复杂的相互协作关系。然而,由于这些在活细胞中的阳离子、阴离子、氨基酸、中性小分子等物种的浓度、电荷以及这些分析物的结合位点的可变性,使得利用该方法选择性和灵敏的监测是不太容易实现的。如果要详细阐述这些活性物种在生命过程中所发挥的功能,从而高效、准确地获取生物体系分子间相互作用的信息来阐明细胞信号转导机制,那么就必须对这些生理功能性物种运用活细胞体系三维示踪和高时空分辨单分子成像新技术在细胞水平上进行原位、实时、动态的可视化监测。进而揭示传统生物学难以发现的新规律,研究传统生物学方法难以解决的问题,推动新药、新靶标和新的药物作用机制的发现。
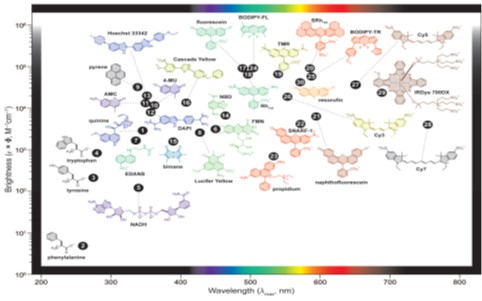
图1.1 常见荧光团亮度及其最大吸收波长[30]
Fig. 1.1 Plot of fluorophore brightness (ɛ ´F) vs the wavelength of maximum absorption (λmax) for the major classes of fluorophores
由于荧光和磷光可以从内置结构中发射出来,即使不直接接触也可以检测(图1.2),所以荧光技术也被称为非侵入性检测技术。与传统检测技术相比,非侵入性检测有着很多优势,它包括高的灵敏度,良好的选择性,短的响应时间,可对检测对象在原位进行实时监控和观察。更重要的是这种检测技术对细胞内活性物种的内源性分布不产生外加干扰, 从而最大程度地得到内源性物种变化的真实信息。有机合成技术可以很容易的实现一个所需新化合物的制备,因此一个有希望的有机合成策略可以成功地处理了一个棘手的生物医学问题。有机合成化学推动了许多科学领域的进步。各种各样的小分子荧光探针和新显微技术的强有力的发展使得荧光显微镜在生物医学和生物学领域起着重要的关键性作用。从这个角度出发,合成化学和生物成像之间的共生关系不断推动着探针设计和检测仪器的协同发展。以有机合成为基础,以生物显微技术为手段,发展能对生命体进行原位、实时、动态的可视化监测的高选择性和灵敏度的分子荧光探针是当前生命科学研究的重要热点和难点领域之一。
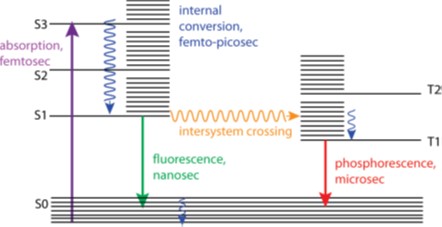
图1.2 发光有机分子的光物理过程和时间尺度的雅布隆斯基(Jablonski)示意图[22]
Fig. 1.2 Jablonski diagram and a time scale of photophysical processes for organic molecules
1.2生物成像荧光探针的设计策略与原理
我们认为在检测条件下,无论什么样的小分子荧光探针都应该对活性物种非常微小的变化有着显著的荧光信号的改变(包括发光强度,波长和寿命的变化),给出可靠的测试结果,同时能避免干扰,尤其是胞内源性物种的干扰。因此,用于有效地监测细胞内功能性物种浓度变化的荧光探针必须满足几个严格的要求,包括良好的选择性,高灵敏性,良好的光稳定性,并有在适当的浓度范围内起作用的能力[23-25]。此外所需的染料要有高荧光量子产率以降低探针在细胞内的用量,这可以最大限度地减少改变内源性物种自然分布的影响。为了最大限度地减少光损伤,避免细胞自体荧光的影响,长波激发和发射荧光团是理想的。最后,探针还必须与生物系统兼容要有一定的水溶解度和低生物毒性。
在小分子荧光探针设计策略上还要十分注意荧光团和识别基团的选择。荧光基团作为信号传感器将识别信息转换成光信号的变化,以显示待测物反应前后荧光试剂的区别。对于识别基团部分,它起着对分析对象有效地进行选择性识别的任务。值得指出的问题是荧光基团和识别基团的链接通过或不通过桥键连接都行。这要看具体的设计思路。对于直接连接的探针,荧光团的某些原子也可能作为识别基团的一部分参与识别过程,光信号的变化结果往往是整个分子结构变化的结果,包括荧光团和识别基团。强荧光物质往往具备以下性质:1)大的刚性共轭π键平面结构;2)具有π,π*型最低的电子激发态S1[26];3)具有供电子的取代基团。因此,理论上所有对发光性能有影响的因素,都可以用来设计荧光探针。
1.2.1改变π电子体系的范围
调节共轭π电子系统不同的程度,通常会改变荧光发射波长和荧光量子产率,甚至是荧光寿命[22,27,28]。如果一个有机荧光化合物能专一性的与分析物相互作用而改变了其π共轭体系的延伸程度,那么这个荧光化合物就可以作为一个分析物的荧光探针[29]。
1.2.2供电子或吸电子基团取代基效应
取代基团对芳香体系荧光特性的影响是复杂的。一般情况下,引进供电子或吸电子取代基团可诱导摩尔吸光系数的增加和荧光光谱的移动。主要的供电子基团有芳香胺类、芳基醚和酚类,而主要的吸电子取代基有醛、酮、腈、酰胺和硝基等基团。
1.2.3光诱导电子转移机理
在荧光分子探针设计过程中,较为常见的是利用光诱导电子转移(Photoinduced Electron Transfer, PET)原理设计的荧光分子探针。这类探针设计原理明确,所得的荧光现象为猝灭或者增强[27,28,30,31]。如果荧光探针的受体部分能提供一个分子轨道位于荧光团的最高占据分子轨道(Highest Occupied Molecular Orbital,HOMO)和最低未占据分子轨道(Lowest Unoccupied Molecular Orbital,LUMO)的能量之间,那么整体上就可以发生分子内PET过程。根据纳入“附近的”轨道的性质[32],荧光团填充HOMO轨道电子和受激发填充LUMO轨道电子向受体空轨道发生的跃迁,这个过程可分为accepter-PET(a-PET)和donor-excited PET(d-PET)过程。此时将发生激发电子无辐射的失活过程,观察到荧光猝灭现象。荧光探针识别分析物后,PET过程受到影响从而导致荧光猝灭或增强。
1.2.4光诱导分子内电荷转移
当两个供电子基和吸电子基组成一个π电子体系时,就会形成电子供体-π共轭桥-电子受体(D-π-A)的分子[27,28,30,33],造成分子内电荷转移(Intramolecular Charge Transfer,ICT),从而改变分子的电荷分布。荧光团形成ICT的结果是有了一个大的极性,可在可见光范围,甚至在近红外区域有强烈的荧光。分子内电荷转移的极端形式就是扭转分子内电荷转移(Twisted Internal Charge Transfer,TICT)[30,33]。
1.2.5磷光重金属配合物中的电荷转移
基于磷光重金属配合物具有独特的d6、d8、d10电子组态也可以设计磷光探针。总的来说,铼(I)、钌(II)、铱(Ⅲ)、铂(II)、锇(II)、铜(I)和Au(I)这些磷光重金属配合物的激发态性质是很复杂的[34-37]。根据金属中心、配体结构、分子内/分子间的相互作用以及所处的化学环境可形成多种激发态。重金属配合物的激发态包括金属配体电荷转移(Metal-to-Ligand Charge-Transfer,MLCT)、内配体电荷转移(Intraligand Charge-Transfer,ILCT)、配体到配体电荷转移(Ligand-to-Ligand Charge-Transfer,LLCT)、金属-金属到配体激发态的电荷转移(Metal−Metal-to-Ligand Charge-Transfer,MMLCT)、以及金属配体-配体电荷转移(Metal-to-Ligand−Ligand Charge-Transfer,MLLCT)状态以及金属中心(Metal-Centered,MC)激发态。不同的激发态可以导致重金属配合物不同的光物理性质。其中一种重金属配合物磷光探针设计策略是配体与分析物识别后所引起π共轭程度的变化。另一种方法是基于配体与分析物的相互作用后光谱产生位移。
1.2.6共振能量转移
共振能量转移(Förster Resonance Energy Transfer,FRET)是两个处于电子激发态的发色团之间的距离相关的相互作用。这个过程是通过无辐射的偶极-偶极耦合作用将激发态从供体发色团转移到受体发色团[38]。当两个发色团均为荧光团时,经常称之为荧光共振能量转移(Fluorescence Resonance Energy Transfer)。FRET的效率取决于分子距离的六次方成反比。在供体与受体之间产生荧光共振能量转移需要满足三个条件:1)供体荧光发射光谱与受体吸收光谱之间具有相当程度的重叠;2)供体与受体偶极具有一定的相对取向;3)供体与受体之间的距离在1-10 nm 之间。通过激发供体荧光团,然后监测受体荧光团和供体荧光团的荧光发射光谱的相对比例来实现检测。
1.2.7稀土配合物的电子能量转移
发光稀土配合物用于光传感和生物成像中应用有发射光寿命长、斯托克斯位移大和发射峰形尖锐等优势[39]。利用该类配合物长的发射光寿命可以选择时间分辨荧光检测生物样品,并可以消除散射光和短寿命自体荧光的干扰。稀土离子的摩尔消光系数比较低,这往往需要有机配体作为敏化剂来敏化将能量转移到稀土配合物的激发态。因此,稀土配合物的发光取决于从配体敏化剂到稀土离子的能量转移效率,这也由配体的化学结构和三重态能量水平所决定的。如果配体与分析物的反应能够改变配体的化学结构和三重态能量水平,那么从配体到稀土离子的能量转移效率将也被改变,从而导致稀土离子的发光特性发生变化。由此可以实现稀土配合物发光探针的设计。
1.2.8激发态分子内质子转移
激发态分子内质子转移(Excited-State Intramolecular Proton Transfer,ESIPT)由于其光谱对环境介质有着独特的灵敏性质,近来也被用于荧光探针的设计[40-42]。ESIPT过程常见机理包含着一个由质子供体基团(例如羟基或氨基)到质子受体基团(例如氧原子或氮原子)的快速激发态质子转移过程,这由分子内氢键(H-bond)控制。ESIPT过程从根本上降低了激发态分子发生光化学反应的可能性,显著增强了分子的光稳定性。另外这个过程还可以观察到明显的大斯托克斯位移。
1.2.9激基缔合物和激基复合物
当两个相同或不同的荧光团等连接到一个受体分子的合适位后,其中一个被激发的荧光团会和另一个处于基态的荧光团形成分子内激基缔合物或激基复合物(Excimer and Exciplex)。此时的发射光谱不同于单体,表现为一个新的、强而宽、长波、无精细结构发射峰[30,32,43-46]。由于形成这种激基缔合物和激基复合物需要激发态分子与基态分子达到“碰撞”距离(~3.5 Å),因此荧光团间的距离是激基缔合物/激基复合物形成和破坏的关键。所以利用改变两个荧光团之间的距离,如用结合客体前后单体-激基缔合物/激基复合物的荧光光谱变化来识别分析物。
1.2.10聚集态的荧光发射
有机荧光团处于聚集态时往往发生荧光猝灭现象,这种效应被称为聚集态猝灭(Aggregation-Caused Quenching,ACQ)[47]。这在很大程度上限制了有机分子荧光团的应用。然而一些有机分子(如1-Methyl-1,2,3,4,5-pentaphenylsilole和tetra- Phenylethene)在溶液中几乎无荧光,如果聚集后则变得荧光强烈。这种现象被定义为聚集态荧光增强(Aggregation-Induced Emission,AIE)[48]。这种设计策略的机理是荧光团的聚集限制了分子内的旋转是导致AIE现象的主要原因。AIE分子在自由状态下不受阻碍的分子内旋转导致相应的激发态的发生有效的无辐射衰减,从而使得不能发出荧光。在一个合适的环境下聚集后,分子内的旋转受到了限制,从而大大提高了荧光发射效率。在这些分子中不太可能形成激基缔合物,所以在聚合状态下不会发生荧光猝灭。基于这种不寻常的荧光特性,AIE的现象已经被成功地运用于设计生物/化学传感器。
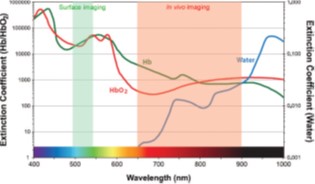
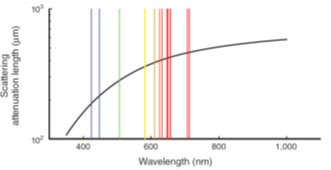
图1.3 水和含氧/脱氧血红蛋白的摩尔消光系数,绘制范围涵盖可见光到近红外光区。下图显示光在人体皮肤组织样本中随波长长度的散射衰减依赖性[4,24,52]
Fig. 1.3 (a) A schema of the in vivo NIR window and the extinction coefficient value of water, oxy- and deoxy-hemoglobin are plotted ranging from visible to near infrared wavelength; (b) The bottom panel shows the wavelength dependence of the scattering attenuation length of a tissue sample of human skin
1.2.11 碳氮双键异构化
近来C=N异构化(C=N Isomerization)也作为信号调控机制用来设计荧光探针。从这一设计理念起源于对构象限制化合物光物理性质的研究。人们发现的C=N异构化是非桥联C=N结构化合物激发态的主要衰变过程,所以这类化合物往往不发荧光[48-51]。相反,由于抑制了C=N激发态的异构化,含有共价结合桥联C=N结构及其类似物的荧光则急剧增加。由此可以利用非共价来桥接C=N键,以络合客体物种后来抑制C=N异构化,从而应用到设计荧光传感分子。
1.2.12上转换荧光
上转换荧光(Up-Conversion Fluorescence)可以被定义为长波长光激发(一般是近红外区650-900 nm),发射则是通常在可见光范围内的波长较短的荧光现象[53-57]。这是一个由低能量光子转换成高能量的光子的比较特别的过程。上转换荧光技术非常适合于研究光致分子内的过程(例如电荷转移和质子转移)和分子间的过程(例如电子转移)。上转换荧光成像技术激发波长在近红外区域,已用于生物细胞和组织的成像。上转换近红外成像技术适于在体外和体内生物成像中应用,这是由于该技术具有众多的优势包括对生物体的光损伤程度低,能避开自体荧光,检测灵敏度高,在生物组织中的穿透深度深(图1.3)。
1.2.13其他设计理念
此外,还有其他一些荧光探针的设计策略,例如三重激发态的干涉:三重态-三重态能量转移(Triplet–Triplet Energy Transfer)和延迟荧光(Delayed Fluorescence) [58,59]、邻基效应(Proximity Effect)[60]和偏振荧光(Fluorescence Polarization)[61]等。
参 考 文 献
[1] Wang R., Yu C., Yu F., et al. Molecular fluorescent probes for monitoring pH changes in living cells [J]. Trends Anal. Chem. 2010, 29:1004-1013.
[2] Stephens D. J., Allan V. J., Light microscopy techniques for live cell imaging [J]. Science 2003, 300:82-86.
[3] Zipfel W. R., Williams R. M., Webb W. W., Nonlinear magic: multiphoton microscopy in the biosciences [J]. Nat. Biotechnol. 2003, 21:1369-1377.
[4] Kobayashi H., Ogawa M., Alford R., et al. New Strategies for Fluorescent Probe Design in Medical Diagnostic Imaging [J]. Chem. Rev. 2010, 110:2620-2640
[5] Giepmans B. N. G., Adams S. R., Ellisman M. H., et al. The fluorescent toolbox for assessing protein location and function. [J]. Science 2006, 312:217-224.
[6] Chen X., Zhou Y., Peng X., et al. Fluorescent and colorimetric probes for detection of thiols [J]. Chem. Soc. Rev., 2010, 39:2120-2135.
[7] Han J., Burgess K., Fluorescent Indicators for Intracellular pH [J]. Chem. Rev. 2010, 110:2709-2728.
[8] Chen X., Tian X., Shin I., et al. Fluorescent and luminescent probes for detection of reactive oxygen and nitrogen species [J]. Chem. Soc Rev. 2011, 40:4783-4804.
[9] Lippert A. R., Van de Bittner G. C., Chang C. J. Boronate oxidation as a bioorthogonal reaction approach for studying the chemistry of hydrogen peroxide in living systems [J]. Acc. Chem. Res. 2011, 44:793-804.
[10] Boens N., Leen V., Dehaen W. Fluorescent indicators based on BODIPY [J]. Chem. Soc. Rev. 2012, 41:1130-1172.
[11] Dsouza R. N., Pischel U., Nau W. M. Fluorescent dyes and their supramolecular host/guest complexes with macrocycles in aqueous solution [J]. Chem. Rev. 2011, 111:7941-7980.
[12] Zhou Y., Yoon J. Recent progress in fluorescent and colorimetric chemosensors for detection of amino acids [J]. Chem. Soc. Rev. 2012, 41:52-67.
[13] Duke R. M., Veale E. B. Pfeffer F. M., et al.Colorimetric and fluorescent anion sensors: an overview of recent developments in the use of 1,8-naphthalimide-based chemosensors [J]. Chem. Soc. Rev. 2010, 39:3936-3953.
[14] Chen X., Pradhan T., Wang F., et al. Fluorescent chemosensors based on spiroring-opening of xanthenes and related derivatives [J]. Chem. Rev. 2012, 112:1910-1956.
[15] Que E. L., Domaille D. W., Chang J. C. Metals in neurobiology: probing their chemistry and biology with molecular imaging [J]. Chem. Rev. 2008, 108:4328-4359.
[16] Domaille D. W., Que E. L., Chang C. J. Synthetic fluorescent sensors for studying the cell biology of metals [J].Nat. Chembiol. 2008, 4:168-175.
[17] Loudet A., Burgess K. BODIPY dyes and their derivatives: syntheses and spectroscopic properties [J]. Chem. Rev. 2007, 107:4891-4932.
[18] Beija M., Afonso C. A., Martinho J. M., Synthesis and applications of Rhodamine derivatives as fluorescent probes, Chem. Soc. Rev., 2009, 38:2410–2433
[19] Jun M. E., Roy B., Ahn K. H., "Turn-on" fluorescent sensing with "reactive" probes [J]. Chem. Commun. 2011, 47:7583-601.
[20] Yang Y., Zhao Q., Feng W., et al. Luminescent chemodosimeters for bioimaging [J]. Chem. Rev. 2013, 113:192-270.
[21] Chan J., Dodani S. C., Chang, C. J. Reaction-based small-molecule fluorescent probes for chemoselective bioimaging [J]. Nat. Chem. 2012, 4:973-984.
[22] Berezin M. Y., Achilefu S., Fluorescence Lifetime Measurements and Biological Imaging [J]. Chem. Rev. 2010, 110:2641–2684
[23] Ueno T., Nagano T., Fluorescent probes for sensing and imaging [J]. Nat. Methods, 2011, 8:642-645.
[24] Kobayashi H., Longmire M. R., Ogawa M., Rational chemical design of the next generation of molecular imaging probes based on physics and biology: mixing modalities, colors and signals [J]. Chem. Soc. Rev., 2011, 40:4626-4648.
[25] Sameiro M., Gonçalves T., Fluorescent Labeling of Biomolecules with Organic Probes [J]. Chem. Rev. 2009, 109:190–212
[26] Itoh T. Fluorescence and Phosphorescence from Higher Excited States of Organic Molecules [J]. Chem. Rev. 2012, 112:4541-4568.
[27] Lakowicz J. R., Principles of fluorescence spectroscopy, 1st ed.; Plenum: New York, 1983.
[28] Guilbault G. G., Practical Fluorescence, 2nd ed.; Marcel Dekker: New York, 1990.
[29] Shi W., Ma H., Spectroscopic probes with changeable π-conjugated systems [J]. Chem. Commun. 2012, 48:8732-8744.
[30] Lavis L, D., Raines R. T., Bright ideas for chemical biology [J]. ACS Chem. Biol. 2008, 3:142-155..
[31] de Silva A. P., Moody T. S., Wright G. D., Fluorescent PET (Photoinduced Electron Transfer) sensors as potent analytical tools [J]. Analyst, 2009, 134:2385–2393
[32] Kim J. S., Quang D. T., Calixarene-derived fluorescent probes [J]. Chem. Rev. 2007, 107, 3780-3799.
[33] Grabowski Z. R., Rotkiewicz K., Rettig W. Structural Changes Accompanying Intramolecular Electron Transfer Focus on Twisted Intramolecular Charge-Transfer States and Structures [J]. Chem. Rev. 2003, 103:3899-4032.
[34] Wong K. M. C., Yam V. W. W., Self-assembly of luminescent alkynylplatinum(II) terpyridyl complexes: modulation of photophysical properties through aggregation behavior [J]. Acc. Chem. Res. 2011, 44:424-434.
[35] Chi Y., Chou P. T., Contemporary progresses on neutral, highly emissive Os(II) and Ru(II) complexes [J]. Chem. Soc. Rev. 2007, 36:1421-1431.
[36] Wong W. Y., Ho, C. L., Heavy metal organometallic electrophosphors derived from multi-component chromophores [J]. Coord. Chem. Rev. 2009, 253:1709-1758.
[37] Yam V. W. W., Lo K. K. W., Luminescent polynuclear d10 metal complexes [J]. Chem. Soc. Rev. 1999, 28:323-334
[38] Förster T. Z., Zwischenmolekulare Energiewanderung und Fluoreszenz [J]. Ann. Phys. 1948, 437:55-75.
[39] Eliseeva S. V., Bunzli J. C. G., Lanthanide luminescence for functional materials and bio-sciences [J]. Chem. Soc. Rev. 2010, 39:189-227.
[40] Sytnik A., Kasha M., Excited-state intramolecular proton transfer as a fluorescence probe for protein binding-site static polarity.Proc [J]. Natl. Acad. Sci. U.S.A. 1994, 91:8627-8630.
[41] Iijima T., Momotake A., Shinohara Y., et al. Excited-State Intramolecular Proton Transfer of Naphthalene-Fused 2-(2′-Hydroxyaryl)benzazole Family [J]. J. Phys. Chem. A 2010, 114:1603-1609.
[42] Zhao J., Ji S., Chen Y., et al. Excited state intramolecular proton transfer (ESIPT): from principal photophysics to the development of new chromophores and applications in fluorescent molecular probes and luminescent materials [J]. Phys. Chem. Chem. Phys. 2012, 14:8803-8817.
[43] Martínez-Máñez R., Sancenón F., Fluorogenic and chromogenic chemosensors and reagents for anions [J]. Chem. Rev. 2003, 103:4419-4476.
[44] Valeur B., Leray I., Design Principles of. Fluorescent Molecular Sensors for Cation. Recognition [J]. Coord. Chem. Rev. 2000, 205:3-40.
[45] Xu Z., Yoon J., Spring D. R., Fluorescent chemosensors for Zn2+ [J]. Chem. Soc. Rev., 2010, 39:1996-2006.
[46] Lodeiro C., Pina F., Luminescent and chromogenic molecular probes based on polyamines and related compounds [J]. Coord. Chem. Rev. 2009, 253:1353-1383
[47] Thomas S. W. 3rd, Joly G. D., Swager T. M., Chemical sensors based on amplifying fluorescent conjugated polymers [J]. Chem. Rev., 2007, 107:1339-1386.
[48] Wu J., Liu W., Ge J., et al. New sensing mechanisms for design of fluorescent chemosensors emerging in recent years [J]. Chem. Soc. Rev. 2011, 40:3483-495.
[49] Yang G. Q., Morlet-Savary F., Peng Z. K., Triplet-triplet Absorption of 2-(2’-hydroxyphenyl) benzoxazole (HBO) in polar solvents [J]. Chem. Phys. Lett., 1996, 256:536.
[50] Li Z. M., Wu S. K., The effect of molecular structure on the photophysical behavior of substituted styryl pyrazine derivatives [J]. J. Fluoresc., 1997, 7:237-242.
[51] Wang P. F., Wu S. K., Spectroscopy and photophysics of bridged enone derivatives: effect of molecular structure and solvent [J]. J. Photochem. Photobiol., A, 1995, 86:109.
[52] Lecoq J., Schnitzer M. J., An infrared fluorescent protein for deeper imaging [J]. Nat Biotechnol. 2011, 29:715-716.
[53] Schfer H., Haase M., Upconverting Nanoparticles [J]. Angew. Chem. Int. Ed. 2011, 50:5808-5829.
[54] Dong X., Yang Y., Sun J., et al. Two-photon excited fluorescent probes for calcium based on internal charge transfer [J]. Chem. Commun. 2009, 3883-3385.
[55] Sun Q., Liu J., Lv X., et al. Rhodamine-inspired far-red to near-infrared dyes and their application as fluorescence probes. [J]. Angew Chem Int Ed Engl. 2012, 51:7634-7636.
[56] Kim H. M, Cho B. R. Two-photon fluorescent probes for metal ions [J]. Chem. Asian J. 2011, 6:58-69.
[57] Yuan L., Lin W., Zheng K., Far-red to near infrared analyte-responsive fluorescent probes based on organic fluorophore platforms for fluorescence imaging. Chem. Soc. Rev. 2013, 42:622-661.
[58] Kwon T. H., Kim H. J., Hong J. I., Phosphorescent thymidine triphosphate sensor based on a donor-acceptor ensemble system using intermolecular energy transfer [J]. Chem.–Eur. J., 2008, 14:9613-9619
[59] Valeur B., Molecular Fluorescence Principles and Applications, Wiley-VCH/Verlag/GmbH, New York, 2001.
[60] Lai T. I., Lim E. C., Proximity effect and excited-state dynamics of 9-carbonyl-substituted anthracenes [J]. J. Am. Chem. Soc., 1985, 107, 1134-1137.
[61] Jameson D. M., Ross J. A., Fluorescence polarization/anisotropy in diagnostics and imaging [J]. Chem. Rev., 2010, 110:2685-2708.
链接地址:于法标博士学位论文:氧化还原近红外荧光探针的合成与生物应用 Synthesis and Applications of Near-Infrared Fluorescent Probes for Biological Redox-Cycles

