Carravilla. P et al. “Molecular recognition of the native HIV-1 MPER revealed by STED microscopy of single virions”, NATURE COMMUNICATIONS | (2019) 10:78
前言: STED显微成像技术是以受激发射耗散(stimulated emission depletion,STED)现象为基础的超高分辨成像技术。与其他超高分辨成像技术相比,STED具有以下优点:1. 同共聚焦一样以扫描方式形成图像,成像速度快,而且无需像单分子定位和结构照明超高分辨技术需要通过后期计算才能得到超高图像。2. 图像分辨率与STED激光功率相关,可以快速灵活调整。3. 受激发射耗散现象是所有荧光分子的基础性质,因此可以选择的荧光染料范围更广。因此自STED技术诞生以来,特别是最近几年以来,STED成像日臻成熟,相关的应用也层出不穷。
为了开阔应用思路,我们今天介绍一篇于2019年发表在《NATURE COMMUNICATION》上的文章。它的独特之处在于,STED是这项研究中使用的唯一方法。
HIV-1型病毒的壳膜蛋白包含gp120和gp41,两者之间以非共价键连接(图1)。对于抗体识别来说,其中gp120的序列和修饰变异很大,作为抗原表位不够稳定,而gp41上面的MPER(membrane proximal external region)区域则相当稳定。此外上世纪九十年代以来发现的一大类高亲和力的抗体(broadly neutralizing antibodies,bn抗体)对这一区域也有很好的结合能力,因此深入了解MPER和bn抗体之间的结合机制,可以为高特异性治疗药物的设计提供很多帮助。但是MPEP这一区域位置特殊,下面紧靠病毒包膜,上部又被gp120所包绕。因此关于MPER是如何暴露出来和bn抗体结合的,一直以来有两种不同的理论:一种理论认为,bn抗体预先和病毒包膜结合,在病毒处于特定状态时才有机会和MPER结合;另一种理论认为,gp41具有多种构象,在某些构象下MPER会自发暴露出来。针对这一不同解释,之前的一些研究手段无法验证。传统的光学显微镜,包括共聚焦显微镜,其最高200nm的分辨率远达不到要求(HIV病毒颗粒只有140nm,而包被在其上的gp蛋白更是又小了一个数量级),而无论是生化手段还是电子显微镜,都需要单独分离MPER区域,无法再现MPER,特别是它和病毒包膜靠在一起时的天然状态。
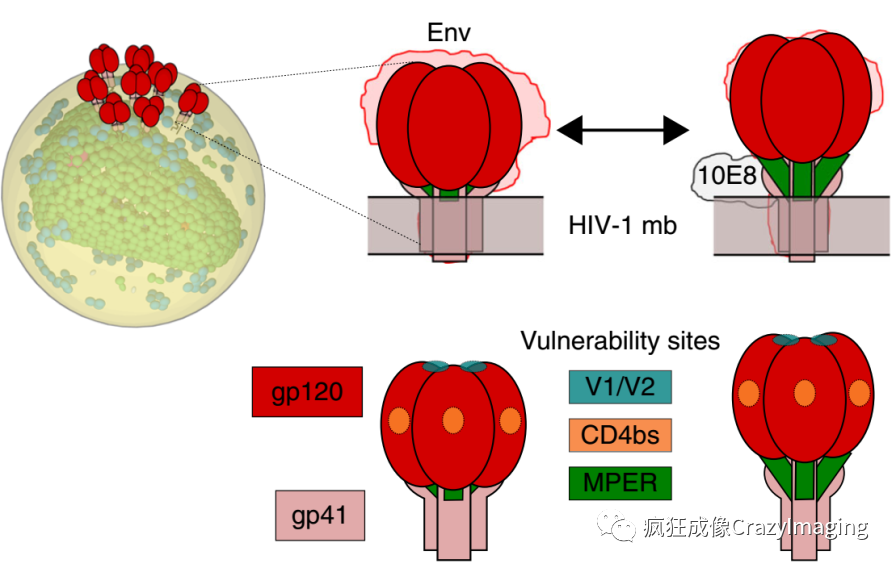
图1. HIV-1病毒颗粒结构
为了回答这一问题,作者使用了德国Abberior Instruments(AI)公司的STED显微镜,该装置具有多个荧光成像通道以及775nm的脉冲STED激光通道,既可以作为STED显微镜使用,同时也是一台性能优秀的共聚焦显微镜。相比于电子显微镜,用STED显微镜做病毒研究有几个独特优势。第一,STED可以做双色共定位,而且可以比其他超分辨成像技术的共定位精度更高。这是因为STED成像不仅可以提高XY平面的分辨率,如果采用适当的技术还可以增加Z轴分辨率。更重要的是,如果用于共定位的两种染料使用同一种STED激光(例如STAR ORANGE and STAR RED, 或者 Alexa594 and ATTO647N),由于两种染料的荧光信号只能来自STED形成的doughnut光斑中心,因此两种染料之间不会产生色差(chromatic shift),故而定位更准确。第二,STED可以实现对活样品的观察。第三,由于STED显微镜也可以做共聚焦成像,因此可以在共聚焦模式下,先利用较大的视野捕捉到那些比较稀疏或罕见的生物事件,然后再用STED进行进一步观察。
作者在第一个实验中用绿色荧光分子标记病毒颗粒,红色标记抗体(Abberior STAR RED,来自AI的姊妹公司Abberior,专为STED成像而优化设计的荧光染料),然后比较了共聚焦和STED的成像效果。可以看到,由于病毒颗粒的大小已经超出了共聚焦的分辨率,因此在共聚焦图像中只能看到红色和绿色的信号混在一起,而在STED图像中则能清晰的分辨出病毒和抗体各自的荧光信号(图2)。
接下来,作者比较了四种抗体/蛋白与病毒颗粒的结合情况。其中,2G12已知与gp120结合,10E8和4E10都属于bn抗体,而Annexin V则是一种与病毒包膜的脂质结合的蛋白。结果证明,bn抗体与病毒的结合能力与2g12相当,同时显著的低于Annexin V,这就证明,bn抗体确实能够和病毒颗粒结合,同时更重要的是这种结合并不通过包膜上的脂质,这就排除了上文提到的第一种理论(图3)。
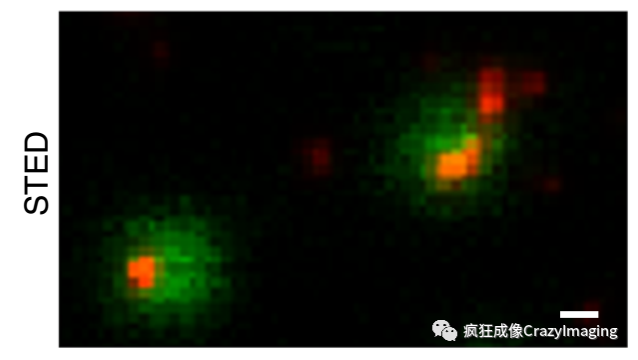
图2.共聚焦和STED的效果比较。Scalebar=100纳米
请注意,STED图里的绿色通道为共聚焦拍摄,作为对照。
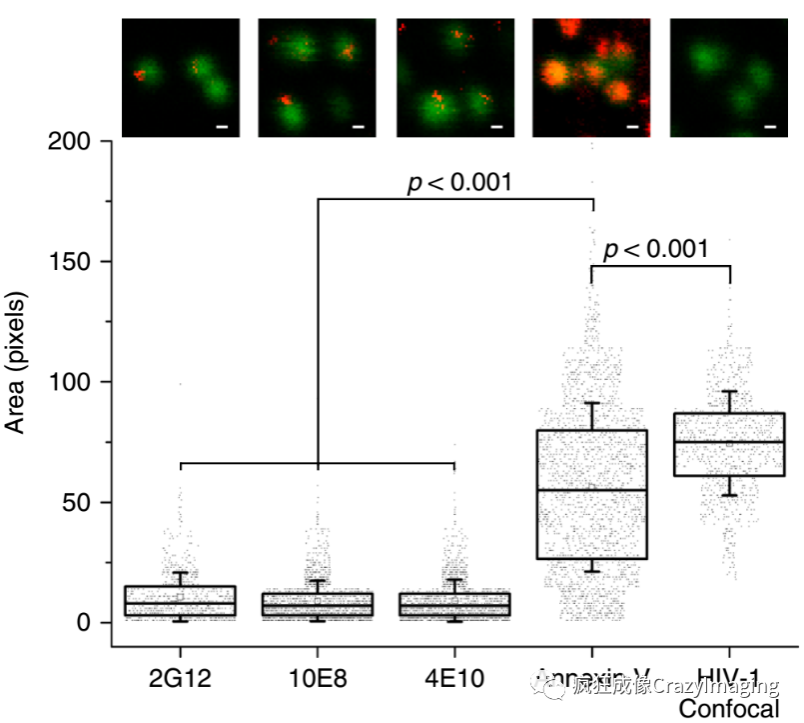
图3.两种bn抗体(10E8和4E10)与病毒颗粒的结合能力
为了进一步研究bn抗体是否真的和包膜蛋白结合,作者又进行了STED双色共定位实验。在这一步中,作者建立了五组实验条件,其中VRC01,PGT145,b12三种抗体已知和gp120结合,第四组中用用两种颜色的荧光染料标记bn抗体(所以两种颜色应该永远共定位),作为阳性对照,最后一组没有使用一抗孵育,作为阴性对照。分析表明,两种bn抗体与VRC01/PGT145/b12三种抗体的共定位系数相似,和阳性对照组也处于同一水平,同时这四组的结果都显著的高于阴性对照组。这说明,bn抗体确实是和包膜蛋白相结合(图4)。当然由于分辨率所限,还不能证明bn抗体是否直接和MPER区域结合。
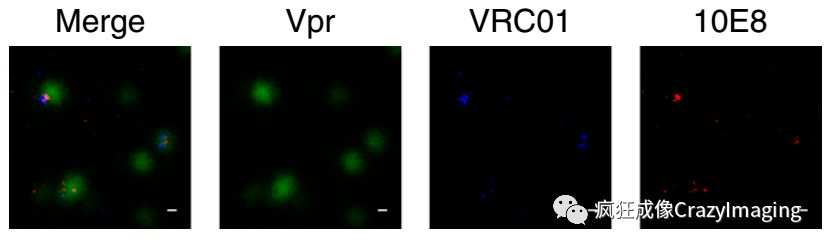
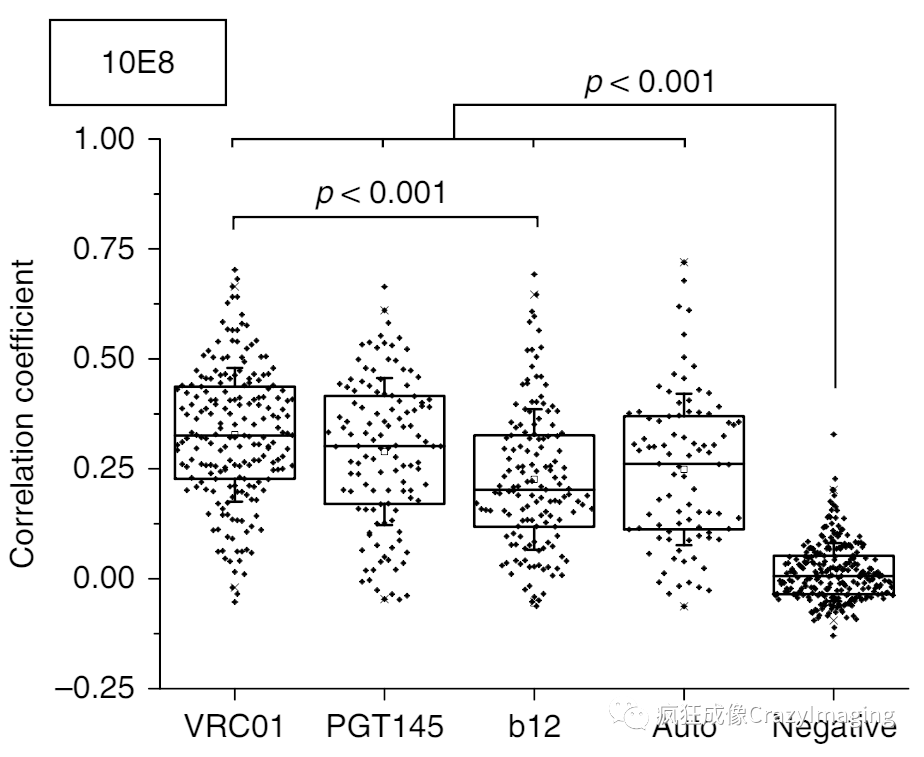
图4. STED双色共定位实验,这里只选取了一种bn抗体(10E8)的结果。
文章的主要结论至此已经很清晰了,但是在附录图表中有一个实验值得一提。在附录三中,作者计算了每个病毒颗粒结合的抗体分子数量,而这一结果得益于AI STED的一个独特优势,即他所用的检测设备是雪崩光电二极管(avalanche photodiode,APD)。APD除了量子效率远高于光电倍增管PMT以外,它的检测是直接对接收到的光子数量计数。由于每个抗体分子在一定条件下发射的荧光光子数量一定,这样经过适当的计算就可以反推得到抗体的分子数(图5)。
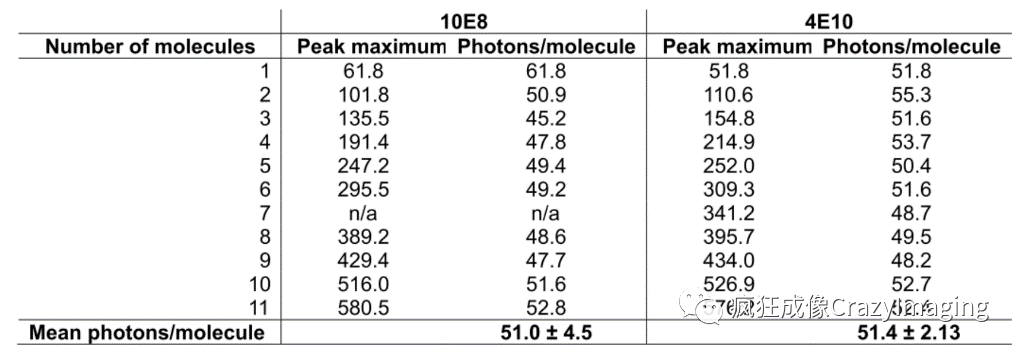
图5.抗体分子数和荧光分子数的对应关系。
受制于篇幅所限,我们没有介绍全部实验。其实文章从技术角度来说确实还有进一步的空间。首先,由于显微镜只配了775纳米的STED激光,因此无法对标记病毒颗粒的绿色荧光进行STED成像。其次,由于分辨率所限,文章其实并没有给出bn抗体和MPER结合的直接证据。好在这两方面的问题都已经有了成熟的解决方案。针对第一个问题,AI公司新推出的平台级和专家级STED显微镜在775纳米STED激光之外,可以另外增加595纳米STED激光,这样就可以进行最多四个通道(488nm,518nm,561nm,640nm)的超高分辨STED成像(图6)。而如果想进一步提到分辨率,还可以考虑AI公司的MINFLUX“显纳镜”,它在X/Y/Z三个方向的分辨率都可以达到2纳米,同时还可以做双色成像,是当前唯一实现纳米级分辨率的光学显微镜(图7)。更具体的信息,请大家移步至本公众号此前的介绍《从显微镜到显纳镜——小于2nm定位精度的光学显纳镜MINFLUX》。

图6. AI公司的平台级STED。可以做四通道STED成像,另外具有活细胞STED,自适应照明,自适应光学等功能

图7. AI公司的MINFLUX显纳镜。X/Y/Z方向分辨率低至2nm以下,并可做双色成像及单分子追踪

