酯是一种非常重要的中间体,酯可以水解制备羧酸,胺酯交换直接制备酰胺,还原得到醛或醇,也可以直接用于关环制备各种杂环。制备酯最常用的方法是酯化反应,是有机合成中最常见的反应之一,另外还有很多方法制备酯,如各种重排反应,水解反应,氧化反应等等制备得到各种酯。下面对其进行汇总方便大家学习,小编只是罗列了一些往期发布的反应,不成系统,后面会继续完善。部分内容非原创,版权归原作者所有。(点击标题可以查看详细内容)。
一、Shiina大环内酯化反应
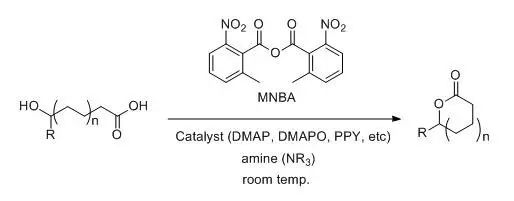
羟基羧酸利用2-甲基-6-硝基苯甲酸酐(MNBA; Shiina试剂),催化量的缩合剂(DMAP, DMAPO, PPY, etc)和三级胺,在温和的条件下进行大环内酯化的反应。此反应是东京理科大学的Isamu Shiina教授在1994年率先报道的,当时是用路易斯酸催化反应。后来又在2002年发表了在碱性条件下利用亲核催化剂进行酯化的方法。
二、Steglich酯化反应
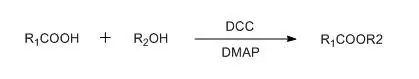
在DMAP催化下,以DCC为偶联试剂的酯化方法。1978年Steglich首先提出【Angew. Chem. Int. Ed. 1978,17,522】,该方法条件温和,可用于位阻大的或对酸敏感底物的酯化,适用于从叔丁醇制备叔丁酯。而传统的Fischer酯化法(酸催化酯化)会导致叔丁醇消除。该法也可用于硫代酸酯的合成。
三、Corey–Nicolaou大环内酯化反应
1974年,E.J. Corey和K.C. Nicolaou报道了复杂的羟基酸底物在温和条件下进行大环内酯化的反应。他们首先将一系列的ω-羟基酸转化为相应的2-吡啶巯基酯,接着将其缓慢的加入到回流的二甲苯中关环得到产物。羟基酸通过形成2-吡啶巯基酯进行分子内酯化得到大环内酯的反应被称为Corey–Nicolaou大环内酯化反应。
四、Yamaguchi酯化反应
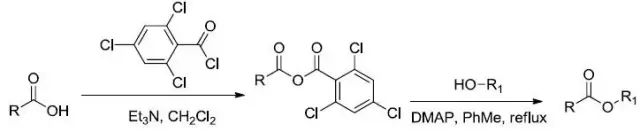
该反应最早是由日本九州大学的Masaru Yamaguchi在1979年报道的。
羧酸和2,4,6-三氯苯甲酰氯作用生成混酐使羧酸得以活化,继而在DMAP的催化下与醇反应生成酯。该反应既可以用于普通酯的生成,也可以用于内酯的生成。对于大环内酯的生成尤为有效,所以在现代天然产物全合成研究中得到非常广泛的应用。
五、费歇尔酯化反应(Fischer-Speier Esterification)
费歇尔酯化反应其实是最经典的酯化反应,我相信只要做有机合成的人基本都用过。羧酸跟醇在酸催化剂下加热合成酯的手法。由于该反应是平衡反应,所以如果想要得到好的产率的话就必须使得平衡往产物方向便宜。通常的方法是加入过量的其中一种原料,并且用Dean-Stark除水。
六、Keck大环内酯化反应
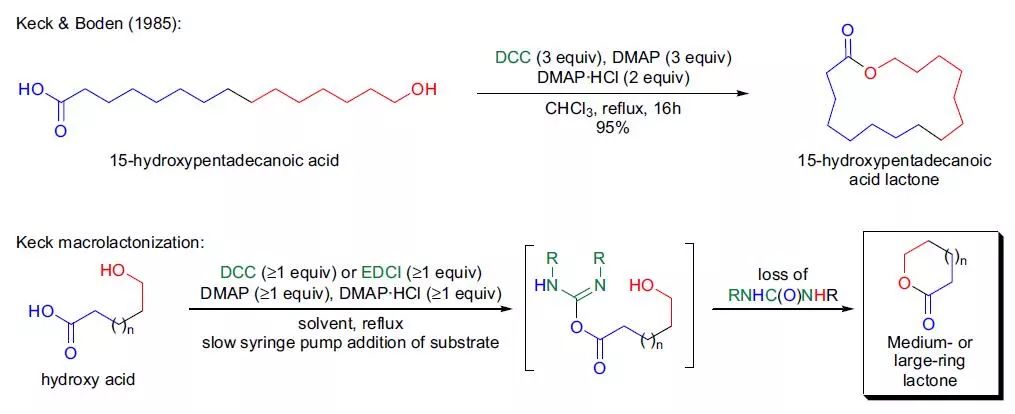
羟基羧酸与二烷基碳二酰亚胺,胺的盐酸盐和胺的混合物作用制备得到中等和大环内酯的反应。
七、Schotten-Baumann反应
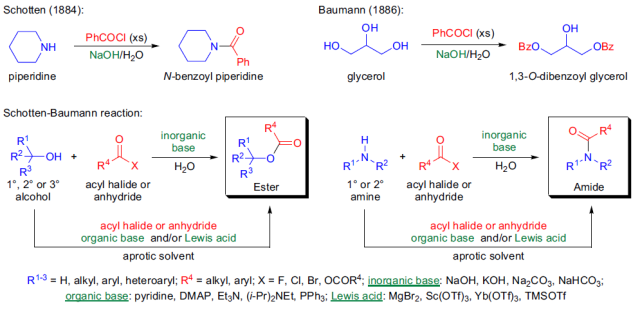
1884年,C. Schotten报道了在水中氢氧化钠存在下由哌啶和苯甲酰氯反应高效合成N-苯甲酰基哌啶的反应。1886年,E. Baumann发现在相同的反应条件下,醇和苯甲酰氯反应可以得到苯甲酸酯,醇和苯甲酰氯在水中混合,然后加入氢氧化钠水溶液,产物酯可以快速高产率的析出。Baumann还发现多羟基的化合物如葡萄糖和甘油也可以利用此反应进行苯甲酰化。在碱的水溶液催化下,醇或胺与酰卤或酸酐反应制备酯或酰胺的反应被称为Schotten-Baumann反应。
八、Mukaiyama试剂,常用试剂----Mukaiyama试剂
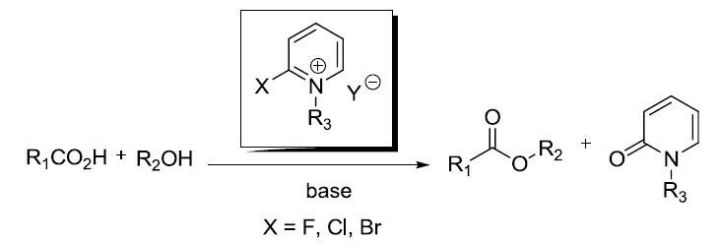
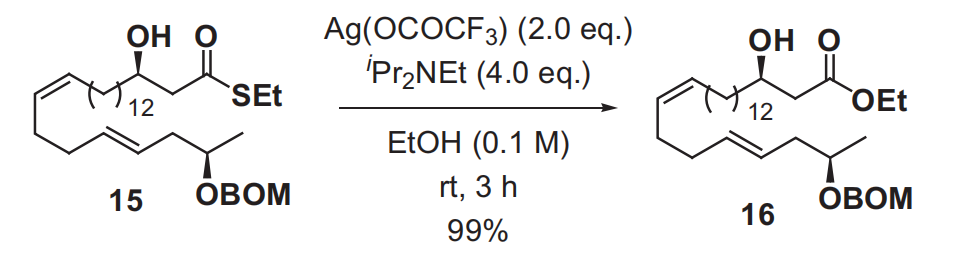
在亲硫性金属盐(如汞盐,银盐或铜盐)催化下,苄基或叔丁基硫酯和醇反应生成酯的反应被称为Masamune酯化反应。
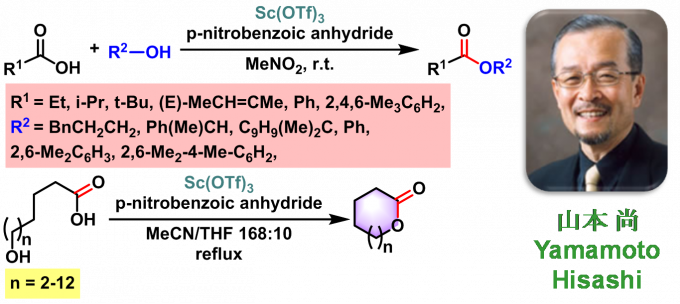
十一、Claisen(克莱森)缩合
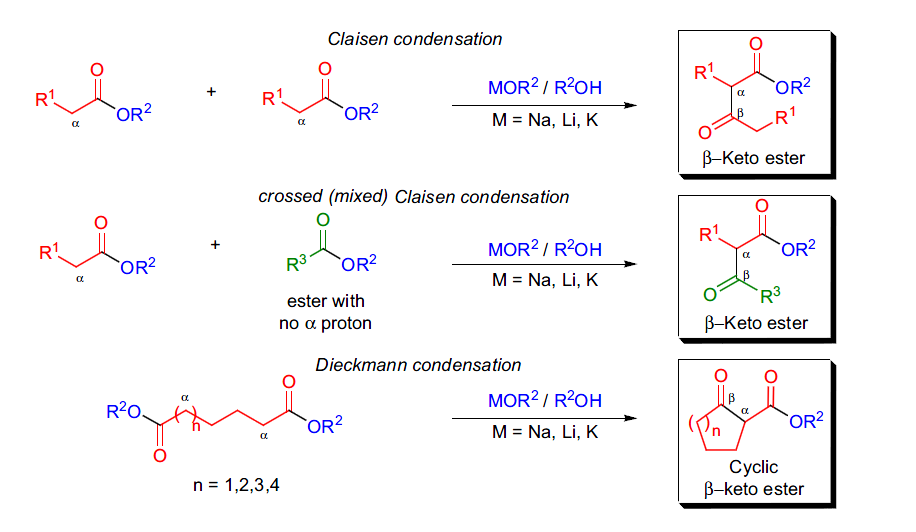
在强碱作用下,含有α-H的酯和另外一分子相同的酯缩合得到β-酮酯的反应被称为Claisen缩合反应。如果发生分子内的酯缩合反应关环,则被称为Dieckmann缩合反应。两种不同的酯在此条件下缩合被称为交叉Claisen缩合反应。
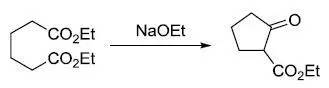
十二、Dieckmann缩合反应
十三、丙二酸酯合成反应
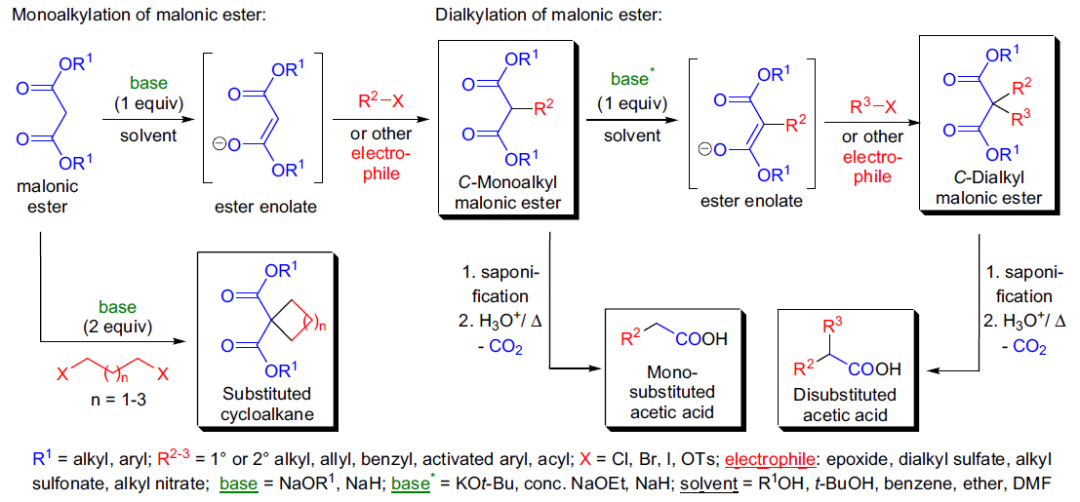
1863年,Geuthe第一次报道了活性亚甲基化合物(亚甲基或次甲基上连有两个吸电子基团)烯醇盐的C-烷基化反应。他首先对乙酰乙酸乙酯进行脱质子,生成的烯醇钠盐和碘乙烷反应得到α-乙酰乙酸乙酯。几十年后, J. Wislicenus研究了丙二酸酯的烯醇钠盐和伯卤代烃及仲卤代烃的烷基化反应,并发现伯卤代烃的反应速率远快于仲卤代烃。丙二酸酯的烯醇盐和各种卤代烃反应进行烷基化,接着脱羧得到取代乙酸衍生物的反应被称为丙二酸酯合成反应。
十四、乙酰乙酸酯合成法(acetoacetic ester synthesis)
乙酰乙酸酯经过C-烷基化,水解,脱羧,合成酮的反应被称为乙酰乙酸酯合成法。
十六、芳基硼酸催化的酰胺化机理

醇的酯化速度远慢于酰胺化速度,因此当底物中含有醇羟基时不影响反应。此条件下如果底物是沸点较高的醇,可以得到较好的效果,分子内的酯化反应可以得到较好的效果。
十七、氨基甲酸酯的保护团(Carbamate Protection)
十八、【醇的保护】环碳酸酯 (cyclic carbonates)
十九、Johnson–Claisen原乙酸酯重排
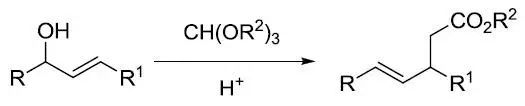
在少量弱酸存在下,加热烯丙醇类化合物与过量的原乙酸三酯反应得到γ,δ-不饱和酯的反应。
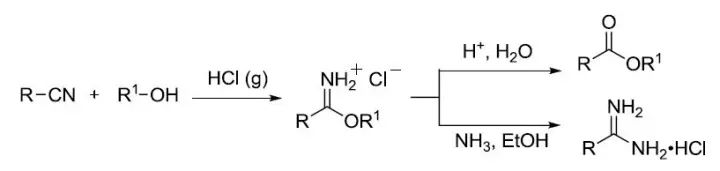
二十、腈的醇解制备酯
Pinner反应
二十一、Wolff重排
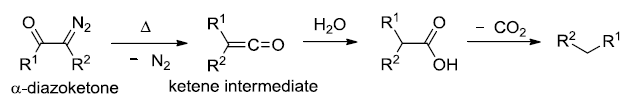
α-重氮酮重排得到烯酮的反应。烯酮是非常重要的有机中间体。可以和水反应制备羧酸,和醇反应制备酯,和胺反应制备酰胺,发生Staudinger烯酮环加成合成各种四元环化合物(可以和烯烃,醛酮和亚胺进行 [2 + 2] 环加成得到环丁酮,β -内酯和β -内酰胺)。
二十二、Mitsunobu反应
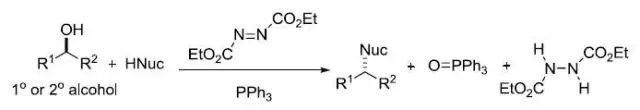
利用偶氮二羧酸酯(通常为偶氮二羧酸二乙酯,DEAD)和三取代膦化物(通常为三苯基膦),亲核试剂和醇进行SN2反应构型翻转得到构型相反的取代产物的反应。
二十三、Hell–Volhard–Zelinsky反应
在加热条件下,催化量的红磷或三卤化磷(PCl3 or PBr3)催化羧酸进行卤代生成α-卤代羧酸的反应被称为Hell-Volhard-Zelinsky反应。此反应最初在1881年由 C. Hell报道,几年后J. Volhard和N. Zelinsky对此反应进行了改进。此反应原始产物为α-卤代酰卤,经过水解后处理得到相应的α-卤代羧酸。然而,在其他亲核试剂(醇,硫醇和胺)存在下进行后处理,则生成相应的酯,硫代酯和酰胺。
二十四、Stobbe condensation
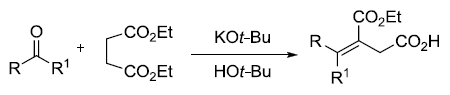
丁二酸二乙酯及其衍生物和羰基化合物在碱性条件下进行缩合的反应。
二十五、Tishchenko反应
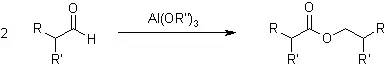
Tishchenko反应,两分子的醛通过歧化反应制备酯的反应。
二十六、Baeyer–Villiger氧化
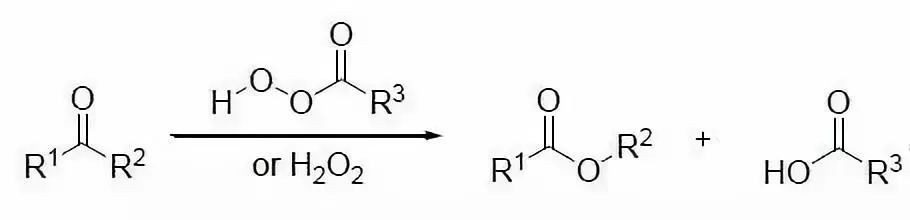
过氧化物氧化醛酮得到酯的反应。
大多数富电子(取代较多的碳)的基团优先迁移。一般的迁移顺序是:叔碳 >环己基> 仲碳 > 苄基 >苯基>伯碳 > 甲基 >> H.
取代芳基的迁移:
p-MeO-Ar > p-Me-Ar > p-Cl-Ar > p-Br-Ar > p-O2N-Ar
二十七、Pinner反应

将腈转化为亚胺酸酯,然后与水或氨反应制备酯或脒的反应。以化学家 Adolf Pinner 的名字命名。一般情况下是在HCl气体催化下,腈在氯仿中醇解得到亚胺酸酯的氯化氢盐,此盐也被称为Pinner盐,其可以和其他很多亲核试剂反应,除了上面提到的水和氨,和过量的醇反应可以得到原酸酯,和硫化氢反应可得到硫代酸酯。
二十八、Favorskii重排
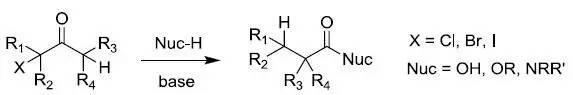
可以烯醇化的α-卤代酮在烷氧基,羟基或胺催化下重排分别生成酯,羧酸或酰胺的反应。
二十九、保护基系列汇总中的羧基保护。
【化学智库】羧酸2-(三甲硅基)乙酯保护羧基
吡啶-2-甲酸酯保护羟基(可中性条件下去保护)
三十、Meerwein芳基化反应
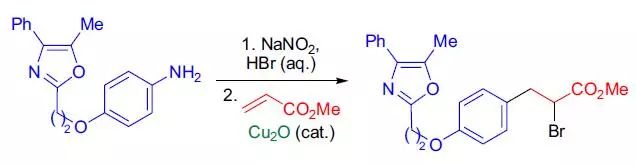
三十一、重氮甲烷(diazomethane)
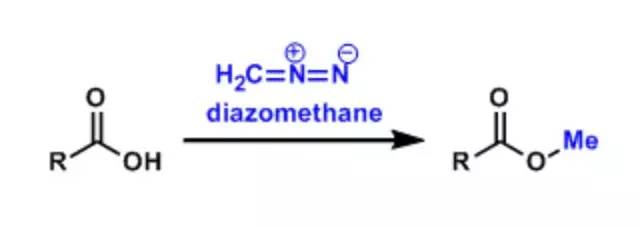
由重氮甲烷制备甲酯。
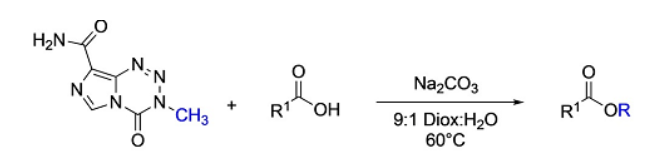
最近来自美国伊利诺伊大学Paul J. Hergenrother等人报道了FDA批准的上市药物TMZ作为一类可称量的,稳定的重氮甲烷等价体(Angew.Chem. Int.Ed. 2020, 59,1857 ),可以安全方便的制备甲酯。
三十二、Chan酰氧基乙酸酯重排反应
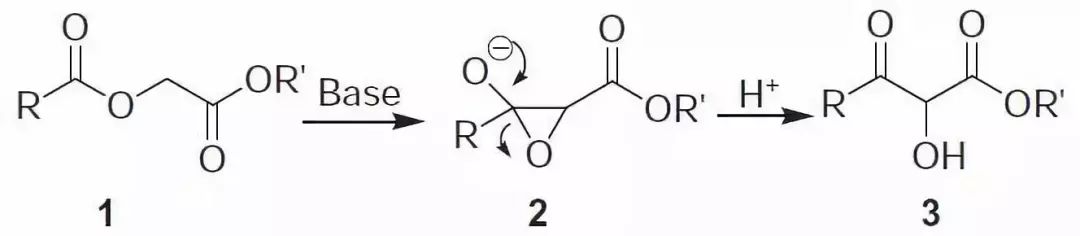
三十三、Stetter反应
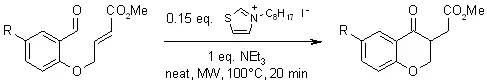
可以以α,β-不饱和羧酸酯为底物进行反应得到4-酮基酯。
三十四、Michael加成反应
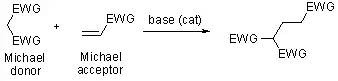
三十五、Reformatsky反应
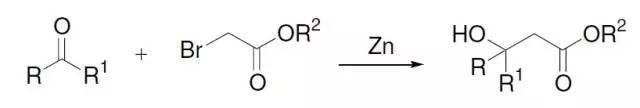
三十六、Knoevenagel缩合反应
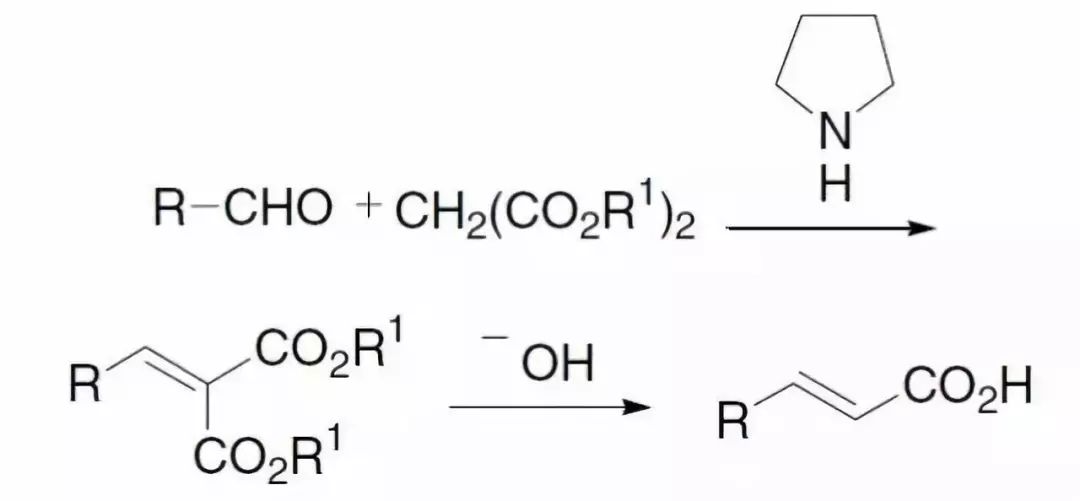
三十七、Arndt–Eistert同系化反应

三十八、Roskamp-Feng反应
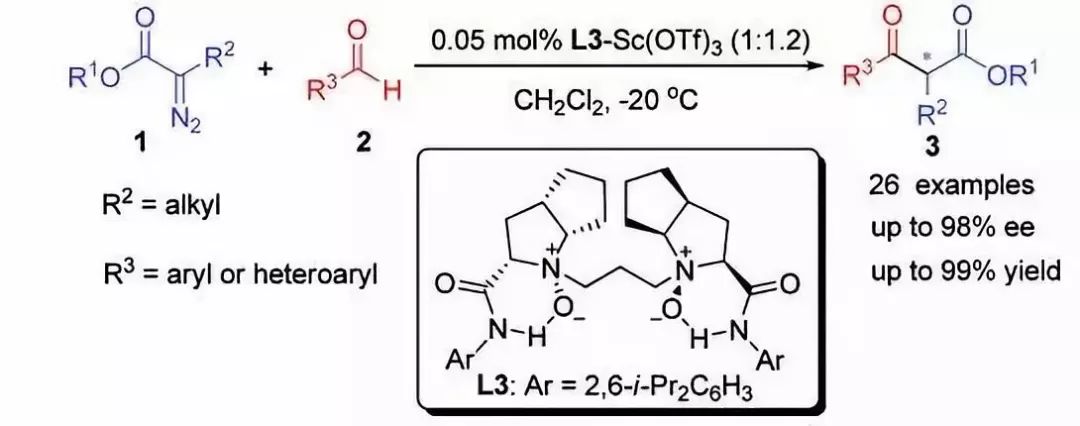
三十九、Fétizon氧化剂
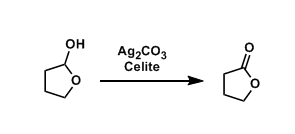
常用氧化剂----Ag2CO3/Celite
四十、LIEBEN HALOFORM REACTION(卤仿反应)
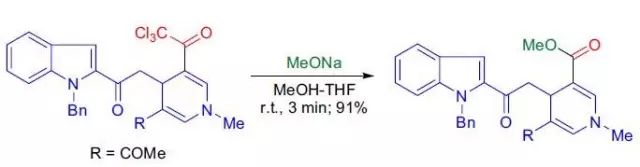
四十一、Mander试剂,常用试剂----Mukaiyama试剂
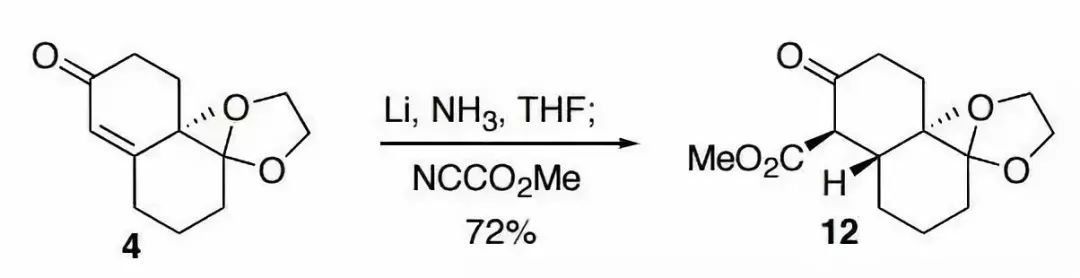
四十二、乙酰基保护酚羟基
四十三、Meerwein 试剂
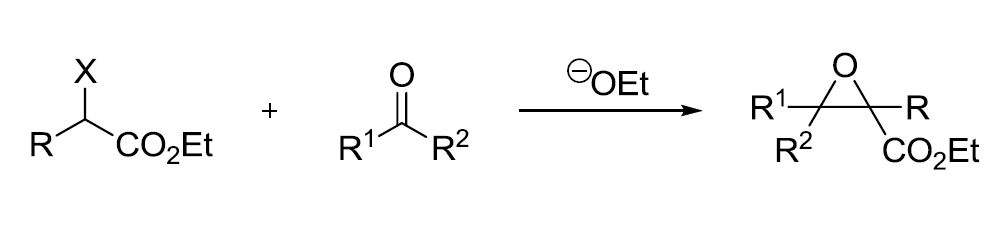
四十四、Darzens缩水甘油酸酯缩合
四十五、Blaise反应
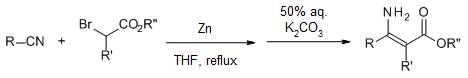
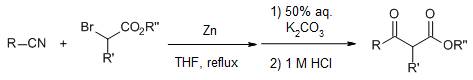
四十六、Baylis-Hillman反应
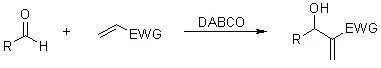
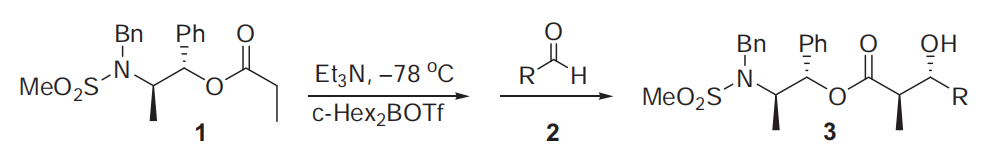
四十七、Abiko-Masamune羟醛缩合反应
来源:

