编者按:最近二十年,尤其是在2014年诺贝尔化学奖授予超高分辨率显微镜技术发明人后的十年间,荧光超分辨显微镜(SRM)技术获得了飞速的发展。如今,通过荧光标记分子,其分辨率已达纳米级别(MINFLUX纳米显微镜)。以往细菌关键过程的细节和动态研究大多被限制于微米范围,超分辨显微镜技术可在纳米或几十纳米的空间分辨率、毫秒级的时间分辨率来研究细菌的结构和功能(如细菌分泌系统筹大分子组装机制)方面价值日益凸显。为了满足在细菌领域运用各类超高技术的老师要求,我们专门选择了Alexander Carsten等人发表于Molecular Microbiology杂志上的综述进行了整理编译。该综述对超分辨率荧光显微镜在细菌研究中的应用,尤其是在细菌分泌系统研究中的应用进行了总结。此外,综述还介绍了最新的MINFLUX超分辨技术,该技术可在单个纳米级别和毫秒范围内精确观测单个分子的运动及其动态相互作用,有望为揭示细菌复杂的分子活动提供全新视角。
原文链接:Carsten A, Wolters M, Aepfelbacher M. Super-resolution fluorescence microscopy for investigating bacterial cell biology. Mol Microbiol. 2024 Apr;121(4):646-658. doi: 10.1111/mmi.15203. Epub 2023 Dec 1. PMID: 38041391.
一、荧光超分辨率显微镜技术
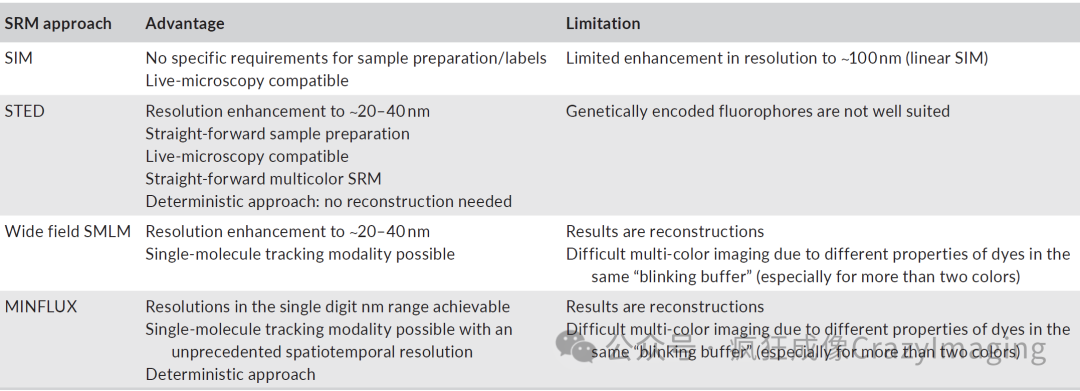
荧光超分辨技术打破了传统200-300nm 的光学衍射极限,实现了更高的分辨率和定位精度。结构光照明显微镜(SIM)作为一种宽场方法,以周期性(多为正弦)激发光照射样品。通过移动和旋转激发光采集多幅图像,再经傅里叶变换算法处理得到最终图像。线性SIM 可将横向分辨率提升至约120nm,轴向分辨率约300nm(Gustafsson 等,2008)。该技术已广泛应用于细菌生物学研究,如对细菌分泌系统成像(Lin 等,2022;Nauth 等,2018)(见图 2a)。
另外两种典型的超分辨技术分辨率可达20-30nm左右,分别是基于激光扫描成像的受激发射损耗(STED)显微镜(Hell & Wichmann, 1994; Klar & Hell, 1999)和基于宽视场成像的单分子定位显微镜(SMLM),包括(直接)随机光学重建显微镜((d) STORM)、光活化定位显微镜(PALM)和纳米尺度点累积形貌成像(PAINT)(Betzig 等,2006; Rust 等,2006; Schnitzbauer 等,2017)。
最小光子通量(MINFLUX)纳米显微镜可以达到低至1nm的分辨率和定位精度。MINFLUX是一种激光扫描单分子定位技术,融合了STED和SMLM的特点。通过确定单个荧光团相对于扫描样品的甜甜圈状激发光中心的位置来精确定位。由于 MINFLUX 甜甜圈状激发光中心强度为零,通过移动激发光束找到最小激发点即荧光分子的精确位置,所以可使用最少量的光子来精确定位荧光团(Balzarotti 等,2017; Schmidt 等,2021)。表1列出了SIM、STED、SMLM 和 MINFLUX 的优势和局限性。
膨胀显微镜也是一种突破衍射极限的成像方法。将生物样本置于可膨胀聚合物基质中进行各向同性扩展,可物理放大生物结构4.5到10倍,实现与所用显微镜技术无关的(伪)分辨率提升(Chen 等,2015; Truckenbrodt 等,2018)。目前,仅有少数研究将膨胀显微镜用于细菌研究(Gotz 等,2020; Kunz 等,2021)。
对生物样品进行荧光显微镜成像,必须用荧光探针标记感兴趣的分子。引入内源性或外源表达分子的标签时,要确保不影响分子功能,同时避免分子过表达产生成像伪影(Bolognesi & Lehner, 2018)。另外,超分辨成像中荧光标记应尽可能靠近目标分子,以充分发挥个位数纳米分辨率的优势。使用一抗和荧光标记二抗时,荧光分子与目标分子距离可达20nm(Fruh 等,2021)。为减少标记误差,可以使用分子距离更小的标记物来做荧光标记,比如使用荧光蛋白、自我标记酶(Self - labeling enzymes,SLEs)如SNAP-tag、Halo-tag、CLIP-tag等和约3nm的纳米抗体等(Banaz 等,2019; Carsten 等,2022; Liss 等,2015; Ries 等,2012;见图 1b)。通过引入含生物正交(“可点击”)侧链的非天然氨基酸,标记误差可降至亚纳米级别(Mihaila 等,2022)。已有文献对适用于超分辨率荧光显微镜的标记方法和荧光探针进行了综述(Liu 等,2022)。
图 1. 以具有核糖体和3型分泌系统(T3SS)的革兰氏阴性菌为例,展示不同荧光显微镜方法的分辨率。(a)携带T3SS(约40nm宽,约150nm长)和核糖体(约20nm直径)的革兰氏阴性杆状细菌(1μm宽,2.5μm长)示意图。椭球体代表共聚焦显微镜、SIM、STED、SMLM 和 MINFLUX 纳米显微镜在x、y和z方向上的分辨率大小。蓝色代表二维,绿色代表三维模式下的分辨率水平。右侧图为 T3SS、其易位子和 YscL 复合体、细菌核糖体及 3D- MINFLUX 三维分辨率的放大显示。IM,内膜;PG,肽聚糖层;OM,外膜;HCM,宿主细胞膜。(b) 3D - MINFLUX三维分辨率和用于荧光标记的常见分子的真实比例展示。从蛋白质数据库(PDB)中获取的结构如下:1igt(IgG),5dty(绿色荧光蛋白),6i2g(NbALFA结合ALFA-tag),6y7a(Halo-tag)和 7k00(细菌核糖体)。
二、荧光超分辨显微镜在细菌生物学中的应用
荧光超分辨显微镜技术可对活细菌细胞中的单个蛋白质进行定位和动态观察,有助于研究细菌的核心过程,如肽聚糖组装、跨膜蛋白质分泌、DNA/RNA 合成以及抗生素抗性相关大分子机器的功能。以下将详细阐述荧光超分辨显微镜和单分子跟踪(single-molecule tracking, SMT)在不同细菌中的应用研究。肽聚糖是许多细菌细胞壁的主要成分,解析其合成过程和定位,对理解细菌构建和维持细胞结构至关重要,在开发新抗生素方面也具有重要意义。借助 STED 显微镜技术,研究人员能够以纳米级分辨率对荧光D-氨基酸标记的细菌肽聚糖成像(Soderstrom 等,2020)。通过生物正交代谢标记和dSTORM技术,揭示了肺炎链球菌中肽聚糖的动态合成过程(Trouve 等,2021)。基于头孢菌素、代谢物和羟胺的荧光特异性探针与d-STORM 结合,展现了金黄色葡萄球菌生长和分裂过程中肽聚糖的动态分子细节(Lund 等,2022)。将 STORM 或 SIM 与原子力显微镜(AFM)相结合(分别称为STORM Force 或 SIMForce),揭示了枯草芽孢杆菌生长和分裂时肽聚糖合成的复杂时空三维动态(Tank 等,2021)。3D-SIM技术的应用揭示了幽门螺杆菌中 bactofilin(CcmA)的分子功能及相互作用分子。CcmA 在细菌独特螺旋形状形成中起关键作用,协调细胞形状决定蛋白与肽聚糖合成机制,组织细胞壁合成和弯曲(Sichel 等,2022)。利用SIM观察荧光标记的teixobactin(一种新型抗生素)在革兰氏阳性菌细胞壁中的相互作用和组织结构,有助于深入理解其作用机制,为开发类似抗生素提供依据(见图 2g;Morris 等,2022)。
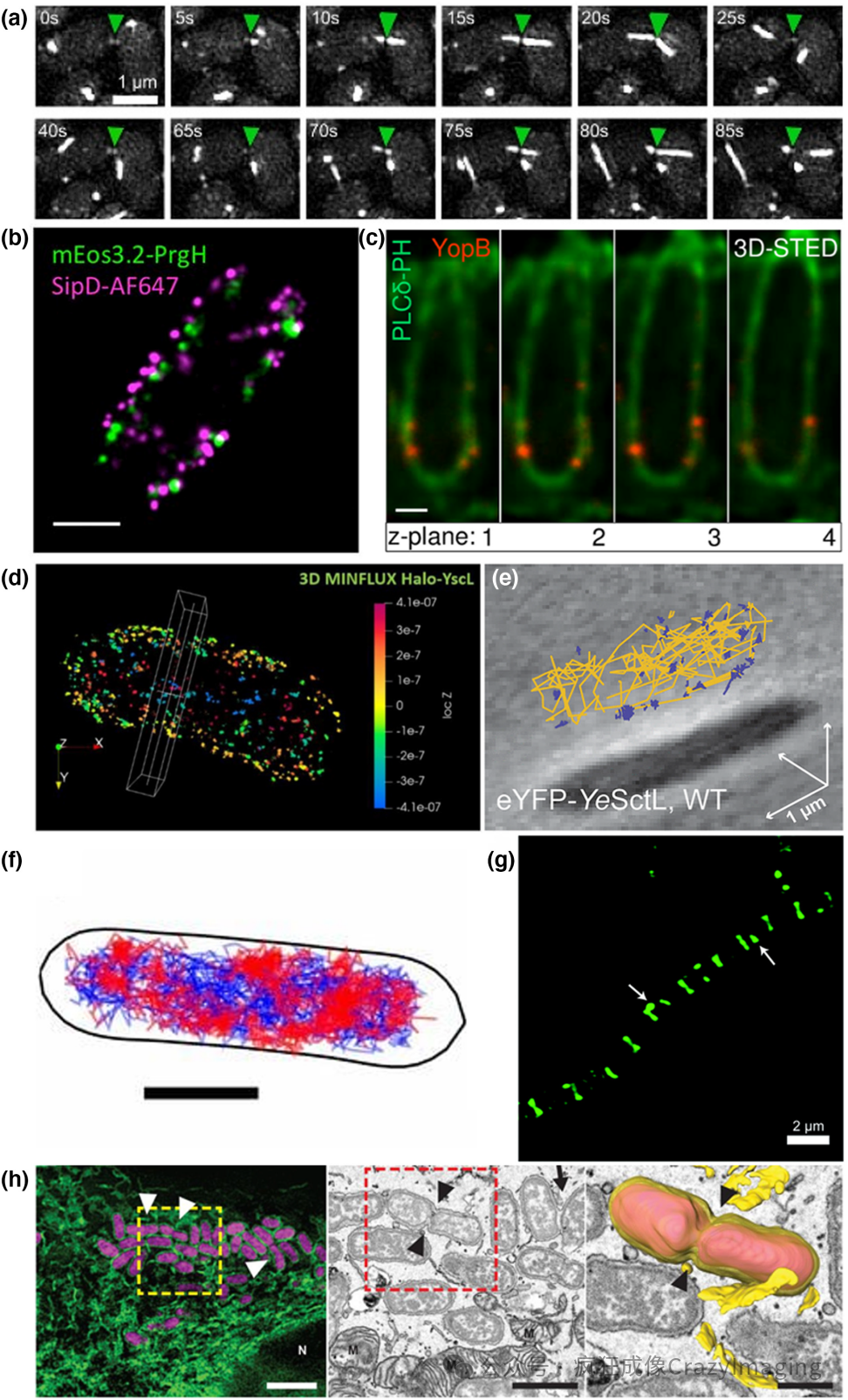
图2. 部分发表的超分辨率图像和追踪实验结果展示。(a)活细胞3D-SIM显示了巴氏不动杆菌中细菌接触依赖性6型分泌系统成分TssB-sfGFP(绿色箭头)在85 s内的动态变化。比例尺:1μm (Lin等,2022)。(b)双色2D单分子定位显微镜显示鼠伤寒沙门氏菌T3SS中mEos3.2-PrgH(绿色)和抗体染色的SipD(洋红色;Alexa Fluor 647)的分布。比例尺:500 nm (Zhang 等,2017)。(c)双色3D-STED显微镜显示抗体染色的小肠结肠炎菌T3SS孔成分YopB(红色;Abberior STAR RED)和抗GFP纳米抗体染色的膜磷脂PIP2特异性荧光探针PLCδ-PH-GFP的共定位成像(绿色;Abberior STAR 580)。比例尺:500nm (Nauth等, 2018)。(d) 3D-MINFLUX显纳镜对Halo-tag标记的小肠结肠炎耶尔森菌T3SS成分YscL的分布进行成像(Alexa Fluor 647染色)。颜色代表Z轴深度。白框区域沿x轴的深度为200 nm (Carsten等,2022)。(e) 小肠结肠炎耶尔森菌中用eYFP标记T3SS成分YscL的3D超分辨率SMT轨迹。蓝色轨迹:扩散系数D*<0.5μm2/s。橙色轨迹:扩散系数D*>0.5μm2/s (Prindle等,2022)。(f)大肠杆菌中PAmCherry标记的RNA聚合酶β亚基(RNAP)的2D-PALM SMT轨迹。红色轨迹:结合RNAP。蓝色轨迹:移动RNAP。比例尺:1μm (Stracy等,2015)。(g)枯草芽孢杆菌用Lys(Cy3)10-teixobactin染色的SIM结果(Morris等,2022)。(h)相关SIM和FIB-SEM断层扫描显示复制型布鲁氏菌液泡(rBCV)的三维结构。左图:表达dsRed的布氏杆菌感染表达Emerald-Sec61β(绿色;ER标记物)的HeLa细胞的SIM结果。比例尺:2μm。N:细胞核。中间图是左侧图像中标记的方框区域的FIB-SEM断层扫描结果。比例尺:1μm。右图是中间图像中标记的方框区域的三维重建结果,展示了细菌(洋红色)、rBCV膜和邻近的ER小池(黄色)。比例尺:500nm (Sedzicki等,2018)。
除了细胞壁的生物合成,研究人员还用 PAINT/dSTORM 技术研究细菌细胞膜和细胞质中的蛋白质。例如,对于来源于李斯特菌(Listeria monocytogenes)的噻唑/恶唑修饰微毒素——李斯特菌溶血素 S(LLS),通过 PAINT/dSTORM 将其定位于细菌细胞膜和细胞质,这有助于理解 LLS 是一种接触依赖性细菌素(Meza Torres 等,2021)。
细胞分裂是生命体增殖的必经过程,细菌分裂主要由骨架蛋白 FtsZ(filamenting temperature-sensitive mutant Z,微管蛋白 tubulin 的同源物)形成的 Z 环驱动。FtsZ 是细菌细胞分裂必需的关键蛋白,也是当前药物筛选的热门靶点。3D-SIM 显示,在史密斯甲烷短杆菌的细胞分裂隔膜中,SepF 与 FtsZ 存在短暂共定位。研究发现,SepF 是 FtsZ 的膜锚定蛋白,能将Z环精确锚定到细胞中部的细胞膜上(Pende 等,2021)。细菌胞外囊泡(Extracellular vesicles, EVs)是由细菌胞体产生和释放到细胞外环境中的膜性囊泡,直径通常为 20-200nm,在基因转移、促进病原菌致病、协助细菌在应激条件存活以及调节细菌相互作用等方面发挥重要作用。利用STORM研究革兰氏阳性菌EVs 的产生,结果表明EVs可能通过外膜起泡和爆发性细胞裂解形成,说明细胞壁降解在其生物合成中起重要作用(Jeong 等,2022)。
2. 黏附素和生物膜
在细菌细胞生物学中,黏附素与细菌生物膜的形成紧密相关。黏附素是细菌表面的蛋白质,能识别并结合特定宿主细胞受体或细胞外基质成分,促进细菌与宿主细胞初始黏附,参与构建复杂的生物膜结构。支原体是已知最小的细菌,大小为300-800nm。利用PALM和 dSTORM技术,研究人员对其表面蛋白和胞质蛋白进行了亚细胞定位。这些细菌因基因组和体积微小,是合成生物学的重要模型,超分辨率显微镜技术的应用极大地增进了对其生物学特性的理解(Rideau 等,2022)。
金黄色葡萄球菌通过纤维连接蛋白结合受体 FnBPA 和 FnBPB 与宿主细胞表面的纤维连接蛋白相互作用实现黏附。DNA-PAINT技术揭示了这些受体在不同大小(100-1000nm)纤维连接蛋白斑块上的黏附情况。结果表明,要实现强黏附,需要足够大(300nm 或更大)的纤维连接蛋白斑块,且至少需要两个或更多细菌受体的参与(Khateb 等,2022)。
微生物生物膜在人类感染和生物技术过程中扮演重要角色,其形成过程复杂,涉及胞外多糖、DNA和其他胞外聚合物的产生。SR-SIM技术的应用揭示了这些胞外聚合物在生物膜中的分布,为理解生物膜结构和功能提供了重要信息(Wang 等,2022)。
3. DNA和RNA代谢
在细菌细胞周期调控中,DNA和RNA代谢至关重要,尽管细菌细胞周期比真核细胞周期简单。荧光超分辨显微镜和SMT技术可实时可视化细菌RNA聚合酶(图 2f)、DNA结合蛋白、DNA复制和转录的精确空间结构以及DNA修复过程(Cassaro & Uphoff, 2022; Stracy 等,2015; Uphoff 等,2013)。
DNA 甲基转移酶(MTases)在限制修饰系统、细胞周期调控和基因表达控制中具有核心功能。结合SMLM和SMT技术研究DNA甲基转移酶的细胞内动力学,发现其优先定位于类核和复制体区域(Fernandez 等,2023)。利用 SMLM 研究大肠杆菌在DNA损伤时,转移性合成聚合酶PolIV在停滞复制叉处的富集情况。事实证明,复制叉上单链DNA结合蛋白的动力学变化可能有助于PolIV的富集(Thrall 等,2022)。用 PAmCherry 标记沙门氏菌致病性岛-2(SPI-2)信号蛋白SsrA/B,结合PALM技术证明SsrA/B在低pH条件下被诱导。此外,运用SMT证明了SsrB在不同pH条件下对DNA的结合特性(Liew 等,2019)。
4. 分泌系统
细菌拥有不同类型的分泌系统,它们是存在于细菌细胞膜上的大分子复合物,能将分子分泌到细胞外或转移到宿主细胞中(Filloux 等,2022)。在细菌病原体中,这些分泌或转移的分子常为致病因子,可用于细菌间竞争、侵入哺乳动物宿主细胞或逃避宿主免疫系统(Galan, 2009; Le 等,2021)。目前已确定 9 种分泌系统,按发现时间顺序命名为第I 型至第IX型分泌系统(T1SS - T9SS)。这些分泌系统结构各异,有的仅由单个蛋白质构成,有的则非常复杂,如III型分泌系统(T3SS)由超过20种不同蛋白质组成(Jenkins 等,2022; Wagner 等,2018)。目前对这些分泌系统结构和功能的认识主要源于遗传学、生物化学、结构生物学和电子显微镜研究(Berger 等,2021; Hu 等,2018; Lunelli 等,2020; Marlovits 等,2004; Worrall 等,2016)。
溶血素 A(HlyA)是细菌I型分泌系统的底物,是革兰阴性菌大肠杆菌分泌的溶血性和细胞毒性蛋白。研究者使用SIM技术观察HlyA在大肠杆菌表面的分布,结果显示HlyA与其他细菌分泌系统不同,在细胞表面无极化现象,且其分布不受细胞生长和分裂周期影响(Beer 等,2022)。VirB6 是农杆菌IV型分泌系统的内膜成分,用sfGFP标记VirB6后,结合SIM技术发现其优先定位于细胞极点(Mary 等,2018)
III型分泌系统(T3SS),又称注射体,存在于革兰氏阴性菌中,可将效应蛋白转移至真核宿主细胞,对耶尔森菌、假单胞菌、志贺氏菌和沙门氏菌等革兰氏阴性菌的致病过程至关重要(Wagner 等,2018)。尽管这些细菌病原体的T3SS在结构上高度保守,但其注入的效应蛋白在结构和功能上差异显著,能操纵宿主细胞多种过程,从而决定病原体与宿主的相互作用及感染结果(Galan 等,2009)。
T3SS宽度约40nm,长度约150nm,由稳定部分(针状复合体、出口装置)和暂时性关联部分(排序平台、尖端复合体、孔复合体)组成。针状复合体是多环圆柱形结构,嵌入细菌细胞包膜,连接着指向细胞外空间、长30-70nm的针丝。针状复合体与出口装置共同形成运输通道,用于运输系统的结构蛋白和效应蛋白(Miletic 等,2021)。针的远端是尖端复合体,参与宿主细胞识别、分泌激活及在宿主细胞接触时调节孔复合体组装(Deane 等,2006;Veenendaal 等,2007)。此外,几种细胞质蛋白形成异源多聚体复合物即排序平台,负责选择和排序待分泌及转移的蛋白质。这些复杂结构和功能确保了T3SS在病原体感染过程中发挥关键作用。
早期研究测试了细菌中Halo-Tag和SNAP-Tag等自标记酶(SLEs)在超分辨显微镜中的适用性。将 SLEs 连接不同的肠道沙门氏菌分泌系统亚基,再用特定透膜染料底物标记,通过dSTORM和SMT技术成像,以确定活细菌中蛋白质的数量、亚细胞定位和动力学(Barlag 等,2016)。后续研究发现,SLEs 融合的肠链球菌 T3SS 效应蛋白转移至宿主细胞后仍保持功能并正确定位(Goser 等,2019)。需注意,标记不同类型蛋白和细菌种类可能影响SLEs的标记效率(Singh & Kenney,2021)。
Sec系统是细菌中重要的蛋白质跨膜转运系统,ATPase SecA是一种ATP酶,为蛋白质通过SecYEG转运体分泌提供动力,在蛋白质跨膜运输中起关键作用。利用PALM技术研究 SecA ATP酶在大肠杆菌中的分布,发现SecA主要定位于细胞质膜,以同源二聚体形式存在并沿质膜扩散。此外,通过SMT技术发现SecA存在三种不同扩散速率的群体(Seinen 等,2021)。
将鼠伤寒沙门氏菌中的各种T3SS成分用荧光抗体或光敏荧光团mEos 3.2标记,采用2D和3D SMLM 成像(图 2b;Zhang 等,2017),可确定针状复合体、排序平台成分、尖端复合体和效应因子的亚细胞分布及大致数量。针状复合体(包括出口装置)几乎全部位于细菌质膜上,而相当一部分排序平台成分分布在细胞质中,表明排序平台与针状复合体是瞬时动态关联的(图 2e;Diepold 等,2017;Prindle 等,2022)。由此,研究人员确定了排序平台和出口装置组分的相对化学计量比,与先前其他技术观察结果一致(Diepold 等,2017;Zilkenat 等,2016)。
由于所用显微镜技术分辨率约为35nm,研究人员在单个注射体中观察到针状复合体蛋白PrgH和尖端复合体蛋白SipD的距离约100nm(图 1a 和 2b)。研究还发现,针状复合体对排序平台组装不可或缺,而效应蛋白SopB主要在细胞质中以簇形式存在,与针状复合体或排序平台并行存在无关(Zhang 等,2017)。
每个细菌与宿主细胞接触后,约形成30个看似单个转位孔的结构,位于注射器针尖,一侧为孔蛋白YopB和YopD,另一侧为针状复合物/基底蛋白组分YscD,平均距离约109nm。利用3D-STED显微镜将YopB蛋白定位在转移孔中,转移孔形成感染细胞中特殊的空泡前腔室(图 2c;Nauth 等,2018)。已有研究表明,AFLA-tag不影响YopD蛋白在小肠结肠炎菌T3SS中蛋白质转位的核心功能(Rudolph 等,2022)。为了尽可能减少 MINFLUX 纳米显微镜的标记误差,将 ALFA 标签引入 YopD 细胞外结构域,结合荧光纳米抗体,用MINFLUX对耶尔森氏菌转移孔中单个YopD-ALFA分子成像。实验结果显示 MINFLUX 定位精度约5nm,从而确定孔大小约 18nm。此外,用 HaloTag 标记由12个分子组成的排序平台蛋白YscL后进行2D和3D MINFLUX成像,各向同性定位精度约5nm,重现了通过冷冻电镜确定的YscL结构大小,直径约16nm(Carsten 等,2022;Berger 等,2021)。在整个细菌中进行的3D MINFLUX实验表明,YscL复合物几乎完全定位在质膜上,且彼此间距很近(相距约 10nm;图 2d;Carsten 等,2022)。
在小肠结肠炎耶尔森氏菌中,分别用eYFP、 eGFP和pamcherry 标记排序平台成分YscQ、YscL和YscN,利用SMT和SMLM技术发现这些蛋白质在细胞质中有不同扩散状态,表明它们在与针状复合体结合前可能形成不同细胞质复合物(图 2e;Diepold 等,2015;Prindle 等,2022;Rocha 等,2018)。YscD是T3SS基座体的组成部分,通过SMT技术观察到在外部低pH条件下,eGFP标记的YscD部分解聚。
近期利用SMT和SMLM技术对Halo-tag标记的肠链球菌效应分子PipB2、SseF、SseJ 和 SifA成像,揭示了SseF、SifA和PipB2沿管状膜结构双向运动,为沙门氏菌SPI-2效应器运动提供了新的信息。此外,通过追踪分析发现,PipB2与GFP标记的宿主蛋白LAMP1 运动模式相同(Goser 等,2023)。
Ⅵ型分泌系统(T6SS)广泛分布于革兰氏阴性变形杆菌(如巴氏不动杆菌、鲍曼不动杆菌和伯克霍尔德氏菌)中,其结构和功能类似可收缩的噬菌体尾针样。TssB是T6SS外鞘的关键蛋白,用sfGFP 标记TssB 后,结合SIM技术观察到收缩鞘的聚合速率、时间及分解情况,发现单个T6SS主要在与邻近细菌接触位置组装,与外膜蛋白OmpA有关(图 2a;Lin 等,2022)。
IX型分泌系统(T9SS)广泛存在于纤维杆菌门、绿菌门和拟杆菌门的革兰氏阴性菌中,用于分泌蛋白质或实现滑行运动。GldL、GldM、GldK和GldN 是T9SS的重要结构蛋白,利用SIM技术研究这些蛋白在黄杆菌中的分布,发现所有蛋白似乎都沿细菌圆周分布在病灶中。GldK和GldN是GldKN复合体一部分,它们在每个细胞中的平均病灶数量比GldL和GldM 少,表明GldLM复合体有两种亚群,一种游离,一种与GldKN环相关(Vincent 等,2022)。
超高分辨显微镜和单分子追踪技术是当前发展极为迅速的超分辨率荧光显微成像技术,在推动细菌生物学研究方面已取得重大进展,其主要优势如下:
(1)STED显微镜能够在活体细菌中对参与复杂过程的荧光标记分子成像,分辨率比传统活细胞荧光显微镜至少高5倍(Stockhammer 等,2020)。
(2)荧光探针的新发展和优化(例如开/关特性、亮度)使荧光超分辨显微镜,特别是对MINFLUX显纳镜的多色和实时成像,以及其相应的单分子追踪变得更加灵活,(Remmel 等,2023)。
(3)目前荧光分子标记方法不断发展,为研究者提供了更多优化实验的先进手段。例如,将ALFA-tag应用于小肠结肠炎菌YopD蛋白研究,结合荧光纳米抗体,可在细菌感染期间对活细菌和宿主细胞中T3SS孔的组装和解聚实现动态观察(Rudolph 等,2022)。另外,MINFLUX显纳镜与PAINT标记方法相结合,可对三个或更多感兴趣分子进行多色成像(Ostersehlt 等,2022)。
将荧光超分辨显微镜与(冷冻)电子显微镜(EM)优势相结合的相关方法,即光电联用显微技术(CLEM),也极具潜力,可获取细菌分子及其与宿主细胞相互作用的高分辨率数据。其中,EM可对细胞结构进行无标记高分辨率成像,荧光超分辨显微镜则可对特异性标记蛋白质进行定位和动态成像。
MINFLUX显纳镜,包括最新技术如MINSTED,能够跟踪分子,可直接观察单个分子运动,这将为复杂分子活动提供全新见解。例如,近期研究观察到的驱动蛋白以8nm步长行走,这在过去是难以想象的(Deguchi 等,2023;wolf 等,2023)。运用超分辨率技术研究细菌中的单分子运动,有助于探究跨膜蛋白质分泌、细胞壁组装和/或 DNA/RNA 合成等过程的分子动态,也为揭示细菌与宿主细胞相互作用提供了新视角。
原文链接:Carsten A, Wolters M, Aepfelbacher M. Super-resolution fluorescence microscopy for investigating bacterial cell biology. Mol Microbiol. 2024 Apr;121(4):646-658. doi: 10.1111/mmi.15203. Epub 2023 Dec 1. PMID: 38041391.
原创文章,欢迎转发

