Complex I Deficiency,线粒体复合物 I 缺乏症是一种线粒体疾病。线粒体是细胞中的特殊隔室,可产生身体所需能量的 90% 以上。在线粒体疾病中,线粒体无法正常工作,导致细胞能量减少、细胞损伤和细胞死亡。复合物 I 是线粒体中产生能量的链式反应的第一步。该疾病是由许多基因中任何一个的遗传变化引起的,遗传模式取决于负责的基因。
线粒体复合物 I 缺乏症是一种称为复合物 I 的蛋白质复合物的缺乏或其功能丧失。复合物 I 存在于称为线粒体的细胞结构中,它将食物中的能量转化为细胞可以使用的形式。复合物 I 是五个线粒体复合物中的第一个,它执行称为氧化磷酸化的多步骤过程,细胞通过该过程获取大部分能量。线粒体复合物 I 缺乏症会导致多种体征和症状,影响身体的许多器官和系统,特别是神经系统、心脏和用于运动的肌肉(骨骼肌)。这些体征和症状可能在从出生到成年的任何时间出现。
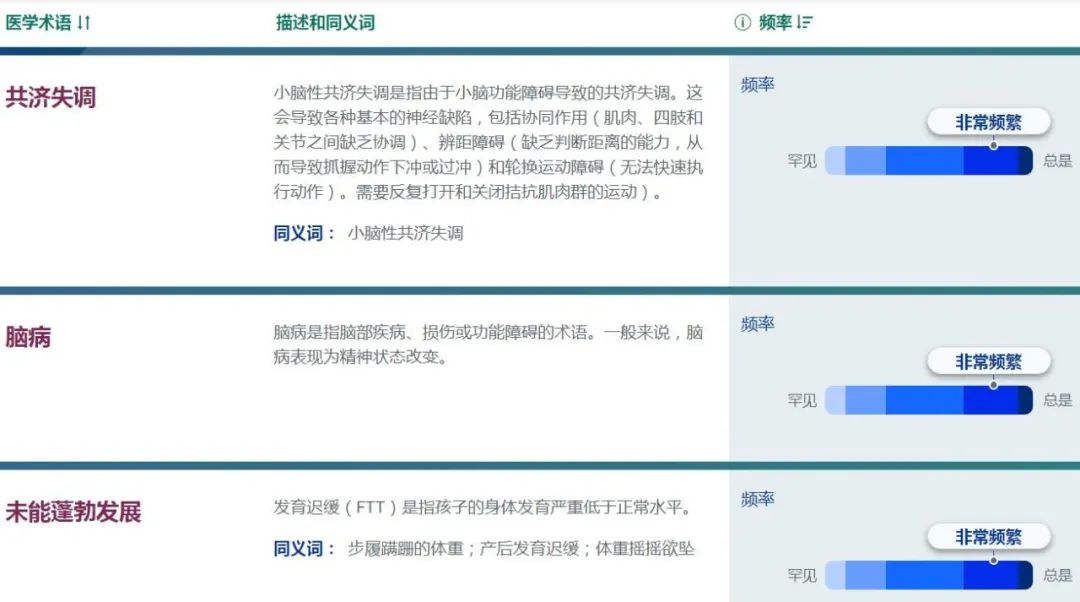
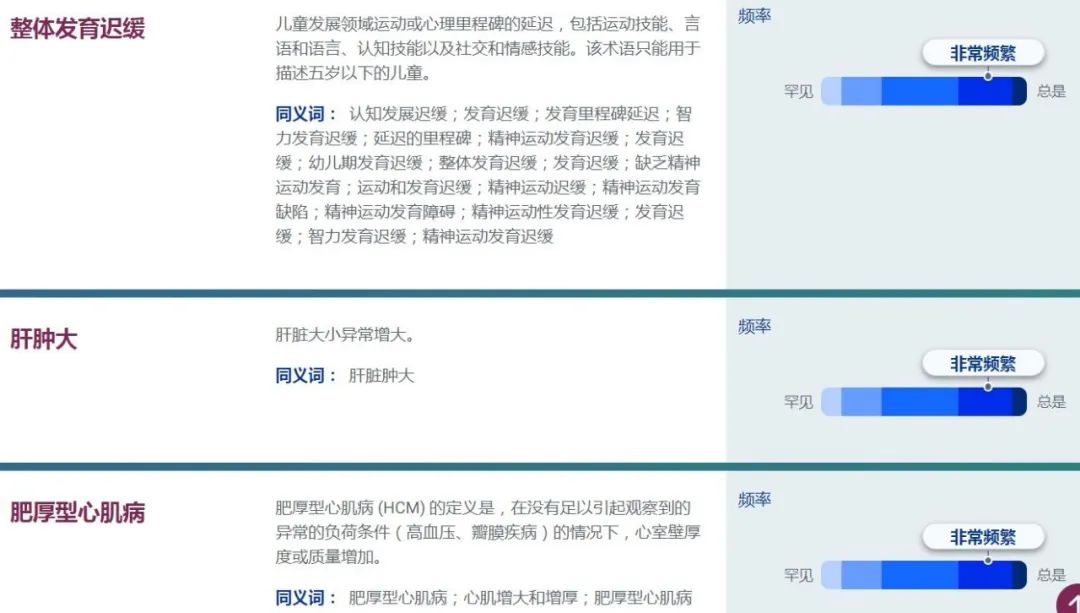
线粒体复合物 I 缺乏症患者通常会出现神经系统问题,例如脑功能异常(脑病)、大头畸形(大头)伴进行性脑白质营养不良、反复癫痫发作(癫痫)、智力障碍、运动协调困难(共济失调)或不自主运动(肌张力障碍)。受影响的个体可能会出现肌张力低(张力减退)、肌肉疼痛(肌痛)和对体力活动的极度疲劳(运动不耐受)。他们的血液中乳酸水平往往升高(乳酸性酸中毒),这会导致恶心、呕吐、虚弱和呼吸急促。在严重的情况下,乳酸性酸中毒可能危及生命。线粒体复合物 I 缺乏症患者有时会出现心脏(肥厚性心肌病)、肝脏或肾脏问题。由于眼睛运动异常或将信号从眼睛传送到大脑的神经(视神经)损坏(退化),也可能会出现视力问题,莱伯遗传性视神经病和某些形式的帕金森病。
一些患有线粒体复合物 I 缺乏症的人会出现一组被归类为特定综合征的体征和症状。例如,Leigh 综合征最常见的原因是线粒体复合物 I 缺乏。Leigh 综合征的特点是精神和运动能力进行性丧失(发育或精神运动退化),通常导致症状出现后 2 至 3 年内死亡。另一种可能由线粒体复合物 I 缺乏引起的疾病是莱伯遗传性视神经病,主要与视神经变性引起的视力问题有关。这些综合症也可能有其他原因。
据认为,每 8,500 人中约有 1 人患有线粒体疾病。线粒体复合物 I 缺乏是儿童线粒体疾病的最常见原因,约占病例的 30%。
疾病其他名称:
复合体 1 线粒体呼吸链缺陷
NADH辅酶Q还原酶缺乏症
复合物 I 的线粒体 NADH 脱氢酶成分,缺乏
NADH:Q(1) 氧化还原酶缺乏
孤立性线粒体呼吸链复合物 I 缺乏症
孤立性 NADH-辅酶 Q 还原酶缺乏症
孤立性 NADH-CoQ 还原酶缺乏症
孤立性 NADH-泛醌还原酶缺乏症
孤立性复合物 I 缺乏症
线粒体疾病合集:线粒体脑肌病
一、病因
许多基因突变可导致线粒体复合物 I 缺乏。大多数这些基因提供了制造复合物 I 的成分或帮助组装复合物的蛋白质的指令。在某些情况下,基因参与影响这些过程的其他功能。
线粒体呼吸链酶复合物 I(烟酰胺腺嘌呤二核苷酸 (NADH):泛醌氧化还原酶,酶委员会编号 EC 1.6.5.3),是线粒体呼吸链 (RC) 和氧化磷酸化 (OXPHOS) 系统中第一个也是最大的酶,在电子转移中发挥着关键作用从还原的 NADH 到辅酶Q10(CoQ10、泛醌)以及泵送质子以维持穿过线粒体内膜的电化学梯度。这种电化学梯度由复合物 I、III 和 IV 产生,随后被复合物 V(ATP 合酶)利用,从 ADP 和无机磷酸盐合成 ATP。复合物 I 也是产生活性氧 (ROS) 的主要位点,人们越来越认识到活性氧是决定线粒体和整个细胞健康和命运的重要信号分子。
复合物 I 的孤立性缺陷是儿童期发病的线粒体疾病中最常见的生化缺陷,约占OXPHOS疾病病例的三分之一。复合物 I 缺乏症在临床上存在异质性,但大多数受影响的个体在生命的第一年出现症状,并且病程迅速进展,导致儿童时期致命。然而,临床表现可能有所不同,从致命的新生儿乳酸性酸中毒到婴儿期发病的 Leigh 综合征、儿童期发病的线粒体脑肌病、乳酸性酸中毒和中风样发作 (MELAS) 综合征,以及在某些情况下,成人发病的脑肌病综合征严重程度。还可以识别单个器官受累的表现,例如孤立性肥厚性心肌病 (HCM) 或莱伯遗传性视神经病 (LHON)。
遗传性复合物 I 缺陷可能是由线粒体 DNA (mtDNA) 或酶的核编码结构亚基的突变引起的,或者是由于任何数量快速增加的核编码复合物 I 组装因子的突变引起的。迄今为止,所有 7 个 mtDNA 编码的复合体 I 亚基、38 个核编码亚基中的 17 个以及 9 个组装因子均已报告有遗传缺陷。致病性 mtDNA 突变可能是母系遗传或散发的,而大多数核编码复合体 I 缺陷是作为常染色体隐性遗传的,尽管有少数 X 连锁缺陷已被报道。
大多数已知与线粒体复合物 I 缺陷有关的基因都存在于核 DNA 中,核 DNA 被包装在细胞核内的染色体中
与这种情况有关的其他基因存在于线粒体 DNA (mtDNA) 中,它位于线粒体本身。人体大部分细胞都含有许多线粒体,每个线粒体又含有多组线粒体DNA。当 mtDNA 发生突变时,要么所有 mtDNA 都会发生相同的变化(同质性),要么只有部分 mtDNA 会包含这种变化(异质性)。线粒体 DNA 突变的比例越高,通常会导致更严重的疾病。
孤立性复合物 I 缺乏症是一种线粒体疾病。这意味着它属于一组影响线粒体产生能量的能力的遗传疾病。
已知以下基因中的某些变异会导致这种疾病:NDUFS8、TMEM126B、NDUFAF4、NDUFV2、FOXRED1、TIMMDC1、NDUFAF1、NDUFS2、ND2、NDUFS1、NDUFA6、NDUFAF5、NDUFA11、NDUFS7、NDUFS3、NDUFA1、NDUFS4、 NDUFS6、NDUFV1、NDUFAF2、NDUFAF8、NDUFB3、ND1、ND3、NDUFB10、NDUFAF3、NDUFB9、NUBPL
二、遗传模式
1、常染色体隐性遗传
常染色体是指基因位于除 X 或 Y 染色体(性染色体)之外的任何染色体上。基因就像染色体一样,通常成对出现。隐性意味着负责基因的两个拷贝都必须有引起疾病的变化(致病变异)才能使人患病。突变是一个较旧的术语,有时仍用于指致病性变异。
患有常染色体隐性遗传疾病的人从其父母那里获得了带有致病性变异的基因。每个父母都是携带者,这意味着他们只有一个基因拷贝具有致病性变异。常染色体隐性遗传病的携带者通常没有任何该疾病的症状。当两个常染色体隐性遗传病携带者生育孩子时,有 25%(四分之一)的机会生出患有该疾病的孩子。
2、X连锁显性
X连锁意味着基因位于X染色体上,X染色体是两条性染色体之一。基因就像染色体一样,通常成对出现。显性意味着当责任基因有两个拷贝时,只有一个拷贝必须有引起疾病的变化(致病性变异)才能使人患病。突变是一个较旧的术语,有时仍用于指致病性变异。
由于女性有两条 X 染色体,因此 X 系显性疾病的致病性变异只需出现在该基因的一个拷贝中即可引起该疾病。由于男性有一条 X 染色体,因此只有该基因的一份拷贝,因此一份拷贝中的致病性变异就足以引起这种疾病。女性的症状可能比男性轻。
携带一种 X 连锁基因变异的女性有 50%(二分之一)的几率生出患有这种疾病的儿子或女儿。患有 X 连锁显性遗传疾病的男性不能将这种疾病遗传给他的儿子,但他所有的女儿都会患有这种疾病。如果孩子是家庭中第一个患有该疾病的人,则致病性变异可能是偶然在孩子身上首次发生的(从头)。
3、线粒体遗传
线粒体是每个细胞中产生能量的结构。每个线粒体都含有称为线粒体 DNA (mtDNA) 的遗传物质。mtDNA 中的致病(致病)变异会影响线粒体为细胞和身体产生能量的能力。当线粒体疾病是由线粒体 DNA 变异引起并从父母遗传给孩子时,称为线粒体遗传。
由 mtDNA 致病性变异引起的线粒体疾病可能出现在家庭的每一代中,影响儿童,无论性别。在人类中,线粒体DNA只能从女性父母遗传给孩子。当人类胚胎首次形成时,它们由来自父母双方的一个细胞组成。mtDNA仅通过来自母本的卵细胞遗传。
也有可能患有非遗传性线粒体疾病。这些仍然可能是由致病性 mtDNA 变异引起的。儿童可能是家庭中第一个患有由 mtDNA 致病性变异引起的疾病的人。儿童线粒体中第一次偶然发生的变异被称为“从头”。
三、临床表型
复合物 I 缺乏症的临床表现极为异质,范围从新生儿发病的乳酸性酸中毒到 Leigh 综合征和其他脑肌病,以及多系统疾病累及和单一器官表现,例如 HCM 或孤立性视神经病。下面描述了更常见的表型以及相关基因。
致命的婴儿乳酸酸中毒
复合物 I 缺乏症最早表现为先天性乳酸性酸中毒,可能出现在新生儿期或婴儿早期。这种疾病通常进展迅速,导致婴儿期死亡,并且与多个核编码复合物 I 亚基(NDUFV1、NDUFS2、NDUFS6、NDUFS8、NDUFA11 和 NDUFB3)和组装因子(NDUFAF3 和 C20ORF7)的突变有关。其中几个基因的突变报道很少,因此很难预测致命性婴儿乳酸酸中毒 (FILA) 是否是这些遗传缺陷的特征性临床表现,或者仅仅反映了严重的复合物 I 缺乏。NDUFS6突变似乎是一个例外,因为这些突变导致来自 4 个不相关家庭的 7 名儿童出现 FILA。
Leigh综合症
复合物 I 缺乏症最常见的表现是 Leigh 综合征,或亚急性坏死性脑脊髓病。受影响的儿童通常具有正常的早期发育,但在婴儿后期或幼儿期出现与脑干和/或基底神经节功能障碍相关的进行性神经异常。临床体征包括呼吸异常、眼球震颤、共济失调、肌张力障碍和肌张力减退。并发疾病可能导致逐步的神经发育退化。通常可能会有一些初步恢复,但永远不会回到基线神经发育轨迹。Leigh 综合征最初是在神经病理学上定义的(双侧对称坏死性病变,其特征是海绵组织增生、神经元缺失、星形细胞增多和毛细血管增殖的组织学四联体),但现在可以根据临床特征、血液中乳酸水平升高和/或在生活中进行诊断。或脑脊液和大脑 MRI 上的特征性表现(T2 加权序列中基底节和/或脑干的双侧对称高信号)。Leigh 综合征是由大脑线粒体能量产生严重受损引起的,并且在生化和遗传上具有极其异质性。尽管任何 OXPHOS 缺陷都可能导致 Leigh 综合征,但孤立性复合物 I 缺乏是最常见的生化异常,占病例的 34%。6 个 mtDNA 编码(ND1、ND2、ND3、ND4、ND5 和 ND6)和 11 个核编码(NDUFS1、2、3、4、7、8、NDUFV1、NDUFA1、2、9、10)复合体 I 的突变迄今为止,亚基和四个组装因子(NDUFAF2、C8ORF38、C20ORF7 和 FOXRED1)已与 Leigh 综合征相关。
白质脑病
其他患有婴儿期发病的复合物 I 缺陷性脑肌病的患者患有脑白质营养不良,其特征是脑 MRI 中的囊性白质变化。这些儿童的临床特征包括进行性肌阵挛性癫痫、呕吐发作、整体发育迟缓和退化、痉挛、肌张力障碍、小脑性共济失调、眼睑下垂、眼肌麻痹、眼球震颤和视神经萎缩。可能存在相关的大头畸形。这种表型与两个核编码复合物 I 亚基 NDUFV1 和 NDUFS1 的突变特别相关,分别有 5 例和 16 例报告。这些患者的神经放射学表现可能与白质消失性疾病相混淆。一名患有NDUFS8突变的患者也出现白质脑病,偶尔患有 NDUFAF4 和 NUBPL 组装因子突变的患者也会出现白质脑病
线粒体脑肌病、乳酸性酸中毒和中风样发作
MELAS 综合征患者通常在儿童时期出现症状,包括癫痫、偏头痛、呕吐、运动不耐受、近端肢体无力和身材矮小。第一次中风样发作(以短暂性偏瘫和/或偏盲为特征,通常先有局灶性癫痫发作)通常发生在生命的最初十年。孤立的复合物 I 缺陷可能出现在 MELAS 综合征中,特别是在具有 ND 亚基突变的个体中。然而,约 80% 的病例是由常见的线粒体转移 RNA (tRNA) 突变 m.3243A>G 引起的,该突变也可能与多种 RC 缺陷相关。中风似乎与核编码复合物 I 缺陷没有特别相关,尽管在两名患有 ACAD9突变的荷兰患者中报告了中风样发作,这种突变通常与运动不耐受和/或心肌病相关。
心肌病
复合物 I 缺乏症可能出现在婴儿期,伴有孤立性 HCM,有时伴有左心室壁致密化不全。据报道,孤立的 HCM 存在核编码亚基(NDUFS2 和 NDUFV2 )和组装因子(最常见的是 ACAD9,通常与运动不耐受相关,但也有 NDUFAF1)的突变。受影响的婴儿可能死于 FILA 46或可能出现相关的进行性脑病,通常属于 Leigh 综合征谱系,据报道,多个基因发生突变:NDUFS2、NDUFS4、NDUFS8、NDUFA2、NDUFA10、NDUFA11和ACAD9)。复合物 I 缺乏症可能导致心肌病未被充分认识,因为可能无法对某些具有严重神经系统症状的患者进行详细的心脏检查。已有mtDNA(例如,m.13513G>A)和核编码(例如,NDUFAF1)复合物I缺陷的患者出现传导缺陷,例如Wolff-Parkinson-White综合征。





四、临床诊断
从临床角度来看,复合物I缺乏症的重要问题是是否存在复合物I缺乏症的特征性临床特征;是否有任何特定的临床特征应引起对特定基因缺陷的怀疑;最后,特定的基因缺陷是否与更好或更差的预后相关。传统上,由于这些疾病存在极端的遗传异质性,因此很难确定线粒体疾病(包括复合物 I 缺乏症)的基因型与表型相关性。此外,即使是最专业的中心也只会看到少数具有特定遗传缺陷的患者,因此医生很难识别可能指向特定诊断的临床线索。偏见的另一个来源是个别临床医生的转诊模式。例如,与代谢科医生或生化遗传学家相比,不同的患者亚组可能会被转介给神经科医生。
通过对所有基因确认的核编码复合物 I 缺陷病例进行系统回顾来解决这些困难,以寻找基因型与表型的相关性,并确定可能有助于加快受影响个体的基因诊断的临床、放射学或生化模式。所有经基因证实的复合物 I 缺陷并伴有核突变的病例均纳入本次审查。仅发现一种突变的病例被排除在外,但 X 连锁 NDUFA1 基因突变的 5 名半合子男性和 1 名杂合女性除外。其他排除标准是明显重复的报告和报告突变但未提供临床信息的病例。该综述总共纳入了 65 篇论文,共报告了 172 名患者:117 名患者存在核亚基突变,55 名患者存在组装因子突变。
患者的临床和生化特征:
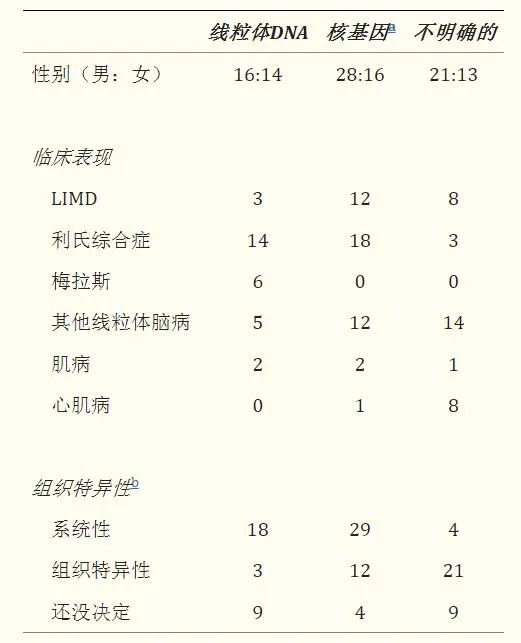
缩写:LIMD,致命性婴儿线粒体病;MELAS、线粒体脑肌病、乳酸性酸中毒、中风样发作。a经产前诊断鉴定出核基因组中的3人并终止妊娠。其中一人的性别尚不清楚,三人的临床表现被认为与其受影响的兄弟姐妹相同。b如果酶在培养的细胞系中表达并且在所有检测的组织中都存在缺陷,则该酶被视为系统性缺陷。如果至少一种组织或细胞系具有正常活性,则将其视为组织特异性。未测定培养细胞系的样品被归类为未测定。
1、基因型与表型的相关性
观察到的总体男女比例为 1.4:1,但根据遗传缺陷亚型细分时,核亚基突变的比例为 1.7:1,组装因子突变的比例为 1:1。核亚基突变男性占优势的原因尚不清楚,因为只有少数病例的 X 连锁NDUFA1基因发生突变。大约 30% 的病例在新生儿期或婴儿期出现症状,另有约 60% 在儿童早期出现症状,这意味着绝大多数患有核编码复合体 I 缺陷的病例在 5 岁之前出现。对于具有核亚基突变和组装因子缺陷的亚组,发病年龄的分布大致相同(数据未显示)。一般来说,生存率和疾病进展率与发病年龄广泛相关。最大的患者亚组患有早发性神经退行性疾病,其症状/体征与 Leigh 综合征谱相符(39% 的病例)。这些患者有 21 个不同基因突变,因此很难推断具有 Leigh 综合征/Leigh 样特征的复合物 I 缺陷的基因型与表型相关性。其他患者出现白质脑病 (14%)、未明确的脑肌病 (9%) 或 FILA (11%)。总体而言,19% 的病例患有 HCM,其中一半以上的病例与 Leigh 综合征或其他脑病相关。其余8%的病例具有杂项临床特征,包括运动不耐受(4%)、肌阵挛性癫痫(2%)、小脑性共济失调(2%)和单例复发性乳酸性酸中毒。根据定义,患有 FILA 的患者的生存率最差,而患有孤立运动不耐受的患者的生存率最高。所有其他表型亚组的进展率和生存率大致相同。装配因子突变的患者的总生存期似乎更长,这主要归因于ACAD9突变和运动不耐受的患者。
大多数基因的缺陷(除仅报道的单个病例外)与相当大的临床异质性相关,。例如,NDUFAF1突变导致一名患者发生致命的婴儿 HCM,但最初为严重的 HCM后来另一位 20 岁时仍然活着的患者的情况有所改善。同样,与C20ORF7突变相关的临床谱包括从新生儿发病的线粒体疾病(导致几天内死亡)到患有相对轻微的 Leigh 综合征(与存活到四十岁相关)的成年人。导致这种观察到的临床变异的因素尚不清楚,但可能的解释包括遗传修饰剂、环境因素(例如,暴露于严重病毒性疾病、手术和其他代谢应激)以及免疫信号改变对表型的调节。缺乏基因型与表型相关性的一个显着例外是ACAD9突变,几乎所有报告的病例都患有 HCM 和/或运动不耐受。这些患者的特征还在于对核黄素补充剂的临床反应。然而,鉴于大多数复杂 I 核亚基和组装因子基因中报告有突变的患者数量很少,很难就基因型与表型相关性得出明确的结论。
2、神经影像学线索
MRI 脑部变化经常在复合物 I 缺乏症患者中观察到,但在大多数情况下既不具有特异性,也不与特定的遗传缺陷相关。对 30 名经基因证实患有复合物 I 缺陷的患者进行的 MRI 扫描单中心回顾性审查显示,100% 的患者存在脑干结构受累,90% 的患者存在基底神经节病变(特别是影响壳核)。脑干病变在 T2 和液体衰减反转恢复 (FLAIR) 序列中表现为高信号,在 T1 加权图像中表现为低信号。在该系列中,中风样病变似乎与 mtDNA 突变相关,而白质脑病则与核亚基突变相关。约 45% 的病例出现小脑受累,且伴有 mtDNA 和核基因缺陷。研究人员Lebre等人报道,在对照组中很少观察到脑干和纹状体病变的组合(MT-TL1突变和丙酮酸脱氢酶缺陷),但没有与导致 Leigh 综合征的其他 RC 缺陷(例如,复杂 IV 缺陷导致)进行比较。SURF1突变和MT-ATP6突变引起的复合物 V 缺陷),可能会出现类似的 MRI 表现。
在我们的系统回顾中,172 名核编码复合物 I 缺陷患者中的 82 名患者获得了详细的 MRI 大脑报告。其中,只有 13% 具有孤立性基底神经节病变,而 28% 具有孤立性脑干病变,24% 具有基底神经节和脑干病变,这支持了脑干病变在复合 I 缺陷 Leigh 综合征中可能特别常见的观点。然而,如上一段所述,需要对利氏综合征的其他原因进行系统研究,以确定这一观察结果的特异性。仅在 NDUFAF2 组装因子发生突变时才观察到高度特异性的神经影像模式:T2 加权扫描上乳头丘脑束、黑质、内侧丘系、内侧纵束和脊髓丘脑束内的脑干病变。这些患者的丘脑和基底神经节没有变化。总之,在我们的回顾中,所有复合物 I 缺陷病例中有 24% 具有白质脑病的神经影像学特征,最常见与NDUFS1(16 例)和NDUFV1(5 例)突变相关,但也有个别病例与NDUFS8、NDUFAF3和NUBPL突变相关。9 例报告小脑受累,3 例记录脊髓病变,4 例患者胼胝体部分或完全发育不全。随着更多患者的基因特征的确定,复合物 I 缺乏亚组可能会出现其他特定的成像模式。目前,累及脑干和基底神经节的 Leigh 综合征的 MRI 表现不能被认为足够具体,以避免需要进行肌肉活检和确定特定 RC 酶活性。
3、组织学线索
大多数患有复合物 I 缺乏症的儿童在肌肉组织学方面仅存在轻微的非特异性异常,例如轻度脂质积累或纤维类型不成比例。参差不齐的红色纤维的存在应引起对潜在 mtDNA 缺陷的怀疑,这可能是大规模重排或点突变,或者 mtDNA 维护或翻译缺陷。参差不齐的红色纤维通常不会在核编码复合物 I 缺陷中观察到,但在具有NDUFS4、NDUFS7、FOXRED1和NUBPL突变的单个病例中出现。此外,偶有报道有线状杆状细胞和复合物 I 缺乏的患者,并且在其中一个病例中最近发现了结构亚基 NDUFB3 的突变。
4、生化线索
在报告的病例中,血浆和脑脊液乳酸经常升高,并且似乎无法区分不同的分子遗传缺陷,核亚基突变患者和组装因子缺陷患者之间也没有任何显着差异。此外,乳酸水平与残留的复合物 I 活性不相关。其他代谢研究(血浆氨基酸和酰基肉碱谱以及尿有机酸)的结果很少被报道,因此不可能就这些是否可以为特定分子遗传缺陷提供诊断线索得出任何结论。正如预期的那样,大多数病例在骨骼肌和成纤维细胞(以及其他组织,如心脏和肝脏)中存在单独的复合物 I 缺乏。在大多数情况下,成纤维细胞中复合物 I 的残留活性高于骨骼肌中的复合物 I 残留活性。残留酶活性与特定遗传缺陷之间似乎没有任何相关性。在偶尔的情况下,会观察到更广泛的 OXPHOS 缺陷;例如,最近的一份报告描述了具有C20ORF7突变的家族中复合物 I 和 IV 的缺陷。同样,据报道,5 名携带NDUFS4突变的患者患有复合物 I 和 III 的联合缺陷,另外两名病例患有复合物 I 和 IV 的联合缺陷。然而,大多数这些基因发生突变的患者都患有孤立的复合物 I 缺陷。对于复合物 I 突变患者存在多种 OXPHOS 缺陷的可能解释是,功能失调的复合物 I 产生的 ROS 增加,导致其他 OXPHOS 酶复合物氧化损伤,或者特定复合物 I 亚基的突变导致 RC 超复合物不稳定,随后降解因此,未组装成超复合物的酶活性丧失。
通过 BNGE 对患者组织中的复合物 I 组装进行分析正在成为一种识别具有异常酶亚组装的患者的方法,并指导对这些患者中特定候选基因的遗传研究。例如,文献中报道的所有具有NDUFS4突变的患者都积累了缺乏 N 模块的约 830 kDa 的子装配体;BNGE 筛查可能是检测该亚组患者的最有效方法。具有 NDUFAF1 缺陷的患者似乎也具有特征性的子装配特征,积累了~400 和~460 KDa 的子装配。
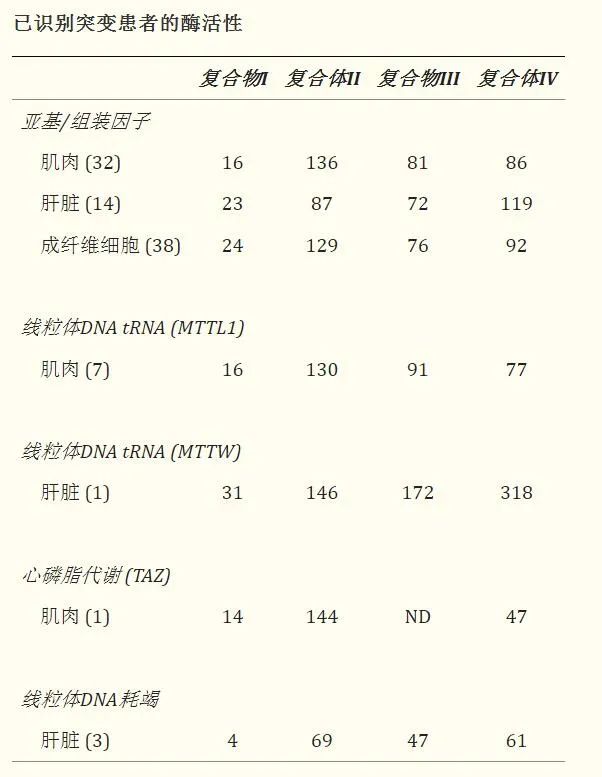
缩写:nd,未确定。酶活性表示为相对于柠檬酸合酶的对照平均值的%。数据是每组的中值,括号中显示每组的患者样本数。
5、继发性复合物 I 缺乏症
复合物 I 缺乏的许多“次要”原因已被报道,其中最著名的是帕金森病 (PD)。复合物 I 缺乏症在 20 世纪 80 年代首次与帕金森病联系起来,当时人们发现,使用MPTP(1-甲基-4-苯基-1,2,3,6-四氢吡啶)的人帕金森病的发病率很高。一种已知的复合物 I 抑制剂。随后,在 PD 受试者死后黑质标本中发现了复合物 I 活性的特异性降低。复合体 I 的mtDNA 编码亚基突变与多种癌症有关,尤其是甲状腺嗜酸细胞瘤。此外,最近发现MT-ND2突变似乎与肿瘤细胞对化疗药物顺铂的耐药性有关。复合物 I 缺乏症还与其他几种疾病有关,包括自闭症、 糖尿病和腓骨肌萎缩症的亚型。
致病机制
虽然 ATP 产生受损无疑是复合物 I 缺乏的一个主要后果,但突变对复合物 I 其他功能的影响也可能在临床疾病的发病机制中发挥重要作用。例如,复合物 I 是 ROS 产生的主要位点,ROS 现在被认为是影响线粒体和其他亚细胞区室之间通讯的重要信号分子。研究表明,复合物 I 缺陷的成纤维细胞中超氧化物的产生与复合物 I 的活性呈负相关。此外,残留活性极低的成纤维细胞的 ROS 水平升高,线粒体形态破碎,表明这些缺陷的线粒体成为自噬破坏或线粒体自噬的目标。缺乏复合物 I 的成纤维细胞中的膜电位降低,并且膜电位与超氧化物衍生的 ROS 水平增加之间似乎存在线性相关性。最后ATP产量减少与 ROS 水平和膜电位密切相关,表明所有这些因素可能在介导疾病发病机制中发挥累积作用。
五、治疗方法
令人失望的是,对于大多数复合物I缺乏症病例仍然没有有效的治疗方法,对症治疗仍然是大多数患者的主要治疗方法。然而,近 20 年来人们就知道,偶尔的患者,特别是那些患有肌病的患者,可能会对补充维生素核黄素 (B2 ) 表现出临床反应。直到最近,除了一名由 m.3250T>C mtDNA 突变引起的复合 I 缺陷性肌病病例外,大多数患者都没有进行基因诊断。核黄素是合成 FMN 和黄素腺嘌呤二核苷酸所必需的。复合物 I 包含单个 FMN 部分,与 NDUFV1 亚基非共价结合,但NDUFV1突变患者似乎对核黄素没有特别敏感。然而,最近的一些报告表明,核编码复合物 I 缺乏症中的核黄素反应性与 ACAD9 缺乏症有关。ACAD9 是一种含有黄素蛋白的酶,最初与长链脂肪酸氧化有关,但现在似乎在复合物 I 组装中具有更令人信服的作用。由于补充核黄素而增加的黄素腺嘌呤二核苷酸可用性被认为可以稳定突变黄素蛋白,从而提高其活性。在一名男性开始核黄素治疗2年后进行的重复活检中,补充核黄素可使携带ACAD9突变的培养成纤维细胞的复合物 I 活性增加约两倍,残余肌肉复合物 I 活性也从 16% 增加至 47%。核黄素治疗(新生儿剂量范围从 50 毫克/天到成人 100-300 毫克/天)已被记录用于 5 名患有ACAD9突变的患者,并且所有病例的症状均得到改善,这些患者均在 5 岁至报告发布时已有 24 年。然而,文献报道的6 名ACAD9突变患者死亡,年龄在 <1 个月至 12 岁之间。报告中尚不清楚这些儿童是否接受了核黄素。
尽管对于所有复合物 I 缺乏症患者都必须进行核黄素治疗试验,但大多数患者不太可能有反应。显然需要其他治疗策略。
最有前途的方法涉及抗氧化化合物或靶向线粒体生物合成。抗氧化剂维生素 E 及其类似物(如 Trolox)在复合物 I 缺乏症中的作用是近期研究的主要方向。另一种抗氧化剂辅酶Q10的类似物已显示出如果尽早给予,有望阻止 LHON 疾病进展。线粒体生物发生可以通过各种药理学试剂来刺激,这些药理学试剂似乎都通过刺激 PGC1α 翻译共激活子的共同途径起作用。苯扎贝特和 AICAR(5-氨基-1-β-D-呋喃核糖基-咪唑-4-甲酰胺)均能刺激 PGC1α,最近显示可改善来自核编码复合物患者的培养皮肤成纤维细胞的线粒体功能的各种指标我不足。
生酮饮食也被提议可以增加线粒体生物合成,生酮饮食对偶尔患有复合物 I 缺乏症的患者有益(未进行临床测试);例如, NDUFV1突变儿童的上睑下垂和眼肌麻痹得到暂时改善。然而,其他报告表明,增加膳食脂肪并不能改善复合物 I 缺乏症。最近两份关于 LHON 大鼠模型成功进行基因治疗的报告为患有这一复合物 I 缺陷亚组的患者带来了希望。
虽然上述策略都显示出希望,但大多数尚未达到临床前试验阶段,在设计针对复合物 I 缺乏症的有效疗法方面仍有大量工作要做。然而,尽管开发新的更有效的治疗方法无疑很重要,但我们不能忽视这样一个事实:迫切需要对最有希望的药物进行精心设计和充分有力的临床试验,宜早不宜迟。
结论
复合物 I 缺乏是儿童期发病的线粒体疾病的常见原因,但相关的临床和遗传异质性导致了相当大的诊断挑战。遗传技术的最新进展,特别是相对便宜的高通量全外显子组下一代序列分析的可用性,在过去两年中鉴定出了大量患者的致病基因。这使得一些初步的基因型与表型相关性得以建立。例如,具有ACAD9突变的患者通常患有 HCM 和/或运动不耐受,而具有NDUFAF2缺陷的患者则患有具有高度特异性神经影像表现的 Leigh 综合征亚型。这些新兴的基因型与表型相关性很重要,因为它们将使诊断过程更加快速,这对于寻求遗传咨询和产前诊断的受影响家庭至关重要。然而,一些表型,特别是 Leigh 综合征,具有极端的遗传异质性,并且报告的许多致病基因发生突变的患者数量太少,无法进行基因型与表型的比较。持续存在的挑战是,尽管进行了高通量测序,但仍有大约 50% 的复合物 I 缺乏症患者无法进行分子诊断。对此有几种可能的解释:确定外显子组测序鉴定的众多变体中哪些是致病性的是一项艰巨的生物信息学任务;突变可能位于内含子或非翻译调控区,并且假设的遗传模式可能不正确(例如,一些患者可能具有从头显性突变,而不是通常假设的严重早发性线粒体疾病(其中 mtDNA 突变)的隐性突变已被排除)。最后,复合物 I 缺乏症的识别应促使开始核黄素治疗,因为一些患者,特别是具有ACAD9突变的患者,可能对补充这种维生素有反应。然而,对于大多数患有这一类毁灭性疾病的患者来说,仍然缺乏有效的治疗方法。最近开发的几种小鼠模型对于候选疗法的临床前试验将具有无价的价值,但仍有许多工作要做。
本文参考
BMJ Publishing Group Ltd
Journal of Medical Genetics 2012; 49 668-668 Published Online First: 10 Oct 2012. doi: 10.1136/jmedgenet-2012-101159corr1
.Respiratory chain complex I deficiency: an underdiagnosed energy generation disorder. Neurology 1999;52:1255–64.
Abstract/FREE Full TextGoogle Scholar
Kirby DM,
Crawford M,
Cleary MA,
Dahl HH,
Dennett X,
Thorburn DR
Structure of the hydrophilic domain of respiratory complex I from Thermus thermophilus. Science 2006;311:1430–6.
Abstract/FREE Full TextGoogle Scholar
Sazanov LA, Hinchliffe P
The architecture of respiratory complex I. Nature 2010;465:441–5.
CrossRefPubMedWeb of ScienceGoogle Scholar
Efremov RG,
Baradaran R,
Sazanov LA
Functional modules and structural basis of conformational coupling in mitochondrial complex I. Science 2010;329:448–51.
Abstract/FREE Full TextGoogle Scholar
Hunte C, Zickermann V, Brandt U

