3月1日,海南医科大学第一附属医院郑少江团队与合作者在《Acta Biomaterialia》上发表了题为“Manganese dioxide-based in situ vaccine boosts antitumor immunity via simultaneous activation of immunogenic cell death and the STING pathway”的研究成果。

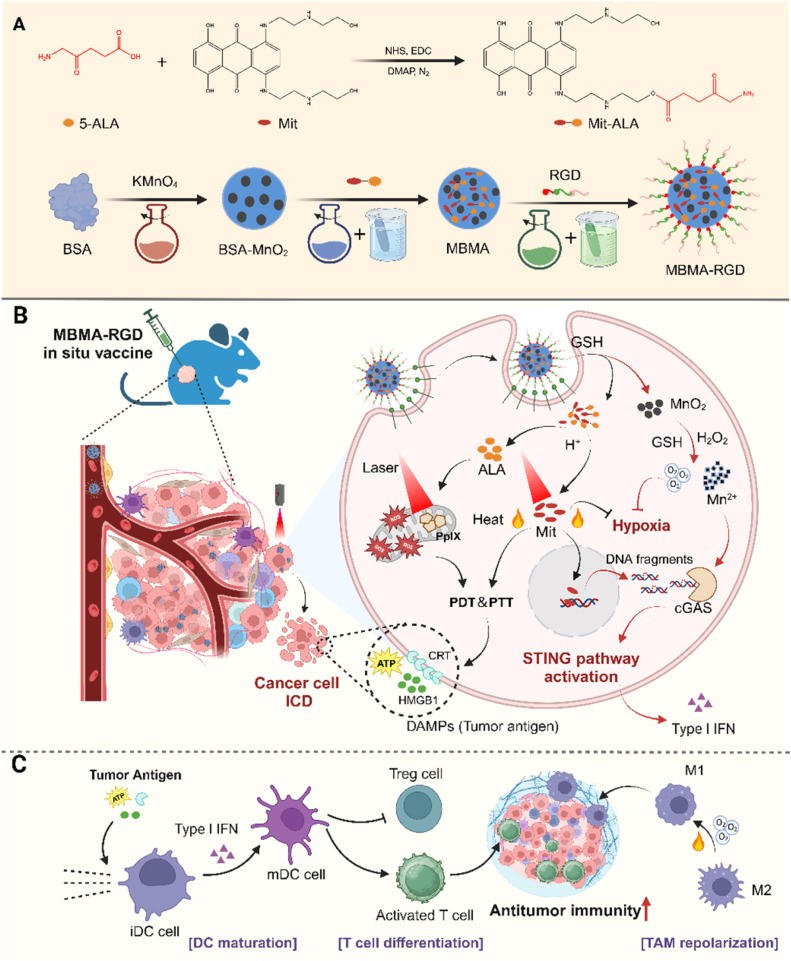
原位疫苗(ISV)通过诱导肿瘤部位免疫原性细胞死亡(ICD)激活抗肿瘤免疫系统,但其发展仍面临肿瘤抗原释放不足及免疫抑制微环境(TIME)等挑战。研究表明,靶向STING通路可通过启动先天免疫增强肿瘤ISV的佐剂效应。基于此,本研究开发了一种高效原位肿瘤疫苗MBMA-RGD ISV,其通过同步诱导ICD与激活STING通路实现持续抗肿瘤免疫:利用pH响应性酯键将化疗药物米托蒽醌(Mit)与光敏剂前体5-氨基酮戊酸(5-ALA)合成水溶性前药Mit-ALA,将其负载于预合成的BSA-MnO2纳米颗粒并经靶向肽Arg-Gly-Asp(RGD)功能化,最终构建MBMA-RGD ISV。该疫苗通过整合素受体介导主动靶向肿瘤细胞,并在肿瘤微环境(TME)响应下逐步释放治疗组分。释放的5-ALA在线粒体代谢生成光敏剂PpIX,激光照射下其光动力特性与Mit的光热效应协同诱导ICD,促进肿瘤抗原释放并激活适应性免疫。同时,Mn2+与Mit通过诱导DNA损伤协同激活STING通路,进一步增强抗肿瘤免疫。此外,MnO2释放的大量氧气可缓解肿瘤缺氧微环境,既增敏光动力治疗又改善TME免疫抑制状态。因此,MBMA-RGD ISV在体外和体内均能高效激活系统性抗肿瘤免疫,且未观察到明显毒副作用,为肿瘤原位疫苗开发提供新策略。
该成果以四川大学华西基础医学与法学院硕士研究生彭佩澜、博士研究生曹蒋军和四川大学华西医院博士后程文婷为共同第一作者,同济大学附属上海市第四人民医院张志奇教授、四川天府锦城实验室主任黄灿华教授和海南医科大学第一附属医院郑少江教授为共同通讯作者。该研究得到国家重点研发项目、国家自然科学基金等项目的资助。
原文链接:https://doi.org/10.1016/j.actbio.2025.01.029

