Nanozymes-Engineered Metal−Organic Frameworks for Catalytic Cascades-Enhanced Synergistic Cancer Therapy
整合纳米酶催化级联反应在疾病中的应用
Chuang Liu, Jie Xing, Ozioma Udochukwu Akakuru, Lijia Luo, Shan Sun, Ruifen Zou, Zhangsen Yu, Qianlan Fang, and Aiguo Wu.Nano Letters 2019 19 (8), 5674-5682DOI: 10.1021/acs.nanolett.9b02253
主讲人:张点奇 2024年5月7日
研究进展:
本篇文章的研究方向是利用纳米酶(nanozymes)和金属有机框架(MOFs)构建催化级联反应的纳米反应器,以增强癌症治疗的协同效应。文章的研究背景是基于天然酶在化学通讯中的高效性,通过有序的催化级联反应可以显著增强酶之间的化学相互作用。然而,由于天然酶存在固有的缺点,如对化学试剂和温度的过高要求以及相对较大的体积,目前在癌症治疗中,利用天然酶构建两个或多个酶的纳米反应器仍然面临很大的挑战。为了克服这些限制,研究人员将目光转向了纳米酶,这是一种具有类似酶特性的纳米材料,作为天然酶的低成本替代品。近年来,纳米酶已经被广泛应用于构建治疗性纳米反应器,用于对抗实体肿瘤。然而,目前的研究主要集中在开发单个纳米酶构建的纳米反应器,对于基于两个或多个纳米酶的催化级联反应的研究还很少。
研究内容:
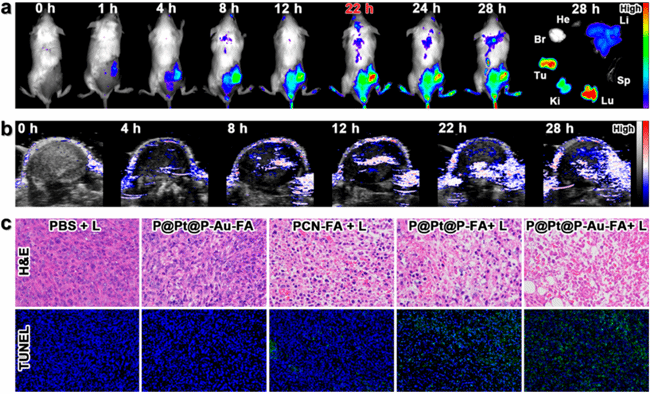
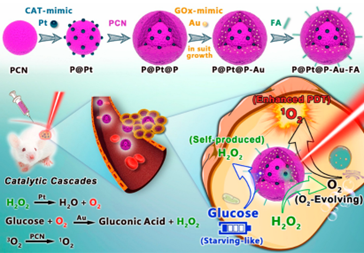
本文提出了一种有序的原位催化级联反应增强协同治疗策略,利用双纳米酶构建的卟啉金属有机框架(PCN)。具体而言,通过将类似催化酶的铂纳米颗粒(Pt NPs)夹在PCN中,然后将类似葡萄糖氧化酶的超小金纳米颗粒(Au NPs)嵌入外壳,并进一步与叶酸(FA)协同作用,形成P@Pt@P−Au−FA。Pt NPs通过催化肿瘤内的H2O2转化为O2,有效缓解肿瘤缺氧,从而增强了依赖氧气的光动力疗法,并通过Au NPs加速β-D-葡萄糖的消耗,实现与自产H2O2协同的饥饿疗法。因此,实现了显著增强的抗肿瘤效果,预防了肿瘤复发和转移。
要点:1.设计了一种新型的纳米反应器P@Pt@P-Au-FA。该纳米反应器利用金属有机框架(MOFs)作为载体,将模拟酶催化剂铂纳米颗粒(Pt NPs)和超小型葡萄糖氧化酶模拟剂金纳米颗粒(Au NPs)嵌入其中,并通过叶酸(FA)的配位实现靶向肿瘤治疗。这种设计使得纳米反应器具备了增强光动力疗法(PDT)和葡萄糖耗竭诱导的饥饿疗法的协同效应,从而提高了抗肿瘤治疗效果。
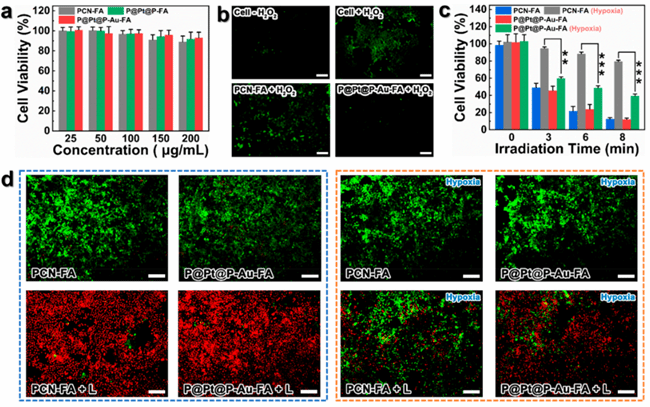
2.不同组别与细胞孵育后的结果进行对比,P@Pt@P-Au-FA的效果得到了验证。
3. 静脉注射 P@Pt@P-Au-FA后,整个肿瘤内的氧饱和度水平得到了提高。