
In vivo bioluminescence imaging of natural bacteria within deep tissues via ATP-binding cassette sugar transporter
深层组织内天然细菌通过ATP结合盒糖转运体的体内生物发光成像
Zhang Q, Song B, Xu Y, Yang Y, Ji J, Cao W, Lu J, Ding J, Cao H, Chu B, Hong J, Wang H, He Y. In vivo bioluminescence imaging of natural bacteria within deep tissues via ATP-binding cassette sugar transporter. Nat Commun. 2023 Apr 22;14(1):2331.
主讲人:羊善宇,2024年9月1日
研究背景:
微生物在健康和疾病中起着许多至关重要的作用。细菌在体内的活动很大程度上受到它们在宿主体内的位置的影响。现有的临床影像学方法如计算机断层扫描(CT)、磁共振成像(MRI)等均可提供体内细菌感染的无创成像。然而,由于它们的选择性相对较差,它们无法区分细菌感染引起的炎症和其他原因(如癌症或自身免疫性疾病)引起的炎症。近年来,光学成像技术可以在分子水平上提供局部、定性和定量的细菌信息。荧光成像作为应用最广泛的光学成像方法,需要实时的光激发,但可能导致生物组织的背景自身荧光,导致信本比相对较差。
由于消除了外部光照射,生物发光成像(BLI)比荧光成像具有几个优点,如低背景,高灵敏度。迄今为止,用于细菌检测的生物发光系统基本可分为两类:(1)内源性BLI系统,通过细菌基因工程表达荧光素酶;(2)外源性BLI系统,在细菌裂解产生的三磷酸腺苷(ATP)存在下,外源性荧光素酶催化外源性荧光素或笼状荧光素底物氧化产生自发光。尽管BLI技术取得了很大的进步,但它在细菌成像方面仍存在固有的不足,主要表现在:“首先,内源性BLI系统需要对细菌进行基因改造;第二,外源性 BLI 系统需要破坏细菌细胞以消耗细胞内 ATP“,因此无法对活细菌进行成像。
一种理论上很有希望但方法上尚未开发的利用生物发光观察体内各种天然细菌的方法,是选择性地将生物发光报告基因递送至细菌细胞中,直接消耗细菌内部的ATP。有趣的是,“特洛伊木马”抗生素策略可以通过细菌铁转运蛋白将铁载体连接的抗生素递送至细菌细胞质中。在我们之前的工作中,我们已经证明了葡萄糖聚合物(GP)修饰的纳米探针可以通过细菌特异性ABC转运蛋白途径内化到各种细菌中。然而,据我们所知,使用“特洛伊木马”策略选择性地将生物发光指示剂递送至细菌中,以前从未有过报道。
研究内容:
为了填补技术空白,我们开始通过ATP结合盒(ABC)糖转运蛋白选择性地将荧光素酶和荧光素递送到各种天然细菌中,方法是将它们搭便车放在α(1-4)-葡萄糖苷连接的葡萄糖聚合物(葡萄糖当量为4.0~7.0)-连接的纳米颗粒上。图1示意性地说明了革兰氏阴性菌和革兰氏阳性菌都可以主动吞噬合成的生物发光探针(即葡萄糖聚合物(GP)、荧光素酶、Cy5和ICG修饰的硅纳米颗粒(GP-Si-BPs))及其底物(GP和D-荧光素修饰的硅纳米颗粒(GP-Si-Luc))。GP(例如,聚[4-O-(α-D-吡喃葡萄糖基)-D-吡喃葡萄糖])作为无处不在的碳源,可以通过ABC糖转运蛋白稳健地内化到细菌细胞中。以大肠杆菌(E.coli)中的ABC糖转运蛋白为例,它有五个亚基:LamB、MalE、MalF、MalG和MalK。在这些亚基中,LamB是一种典型的外膜扩散孔蛋白,MalE可以识别α(1-4)-葡萄糖苷连接的GP分子。通过利用这种摄取机制,小尺寸(例如,~5nm)GP修饰的纳米颗粒,包括硅纳米颗粒、金纳米颗粒和碳点,最近已被证明可以选择性和稳健地内化到细菌细胞中。类似地,我们在这里展示了不同的细菌吃它们伪装的“食物”,即GP-Si-BPs和GP-SiLuc。GP-Si-Luc中的荧光素在细菌细胞内直接被ATP激活后,随后在GP-Si-BPs中的荧光素酶催化氧化。通过进一步采用能量转移继电器,该继电器集成了荧光素酶和Cy5之间的生物发光共振能量转移(BRET)以及Cy5和ICG之间的荧光共振能量转移(FRET),开发的TrojanBLI探针实现了深层组织内细菌的近红外(NIR)成像。此外,ICG的负载允许在近红外照射下光热杀灭细菌。我们证明了所提出的特洛伊木马BLI策略允许对细菌性眼内炎患者玻璃体中的10种细菌进行离体生物发光成像。我们还证明,所提出的特洛伊木马BLI策略不仅可以选择性和灵敏的成像,还可以在小鼠细菌性肾炎和结肠炎的概念验证模型中对深层组织中的病原体进行光热疗法。
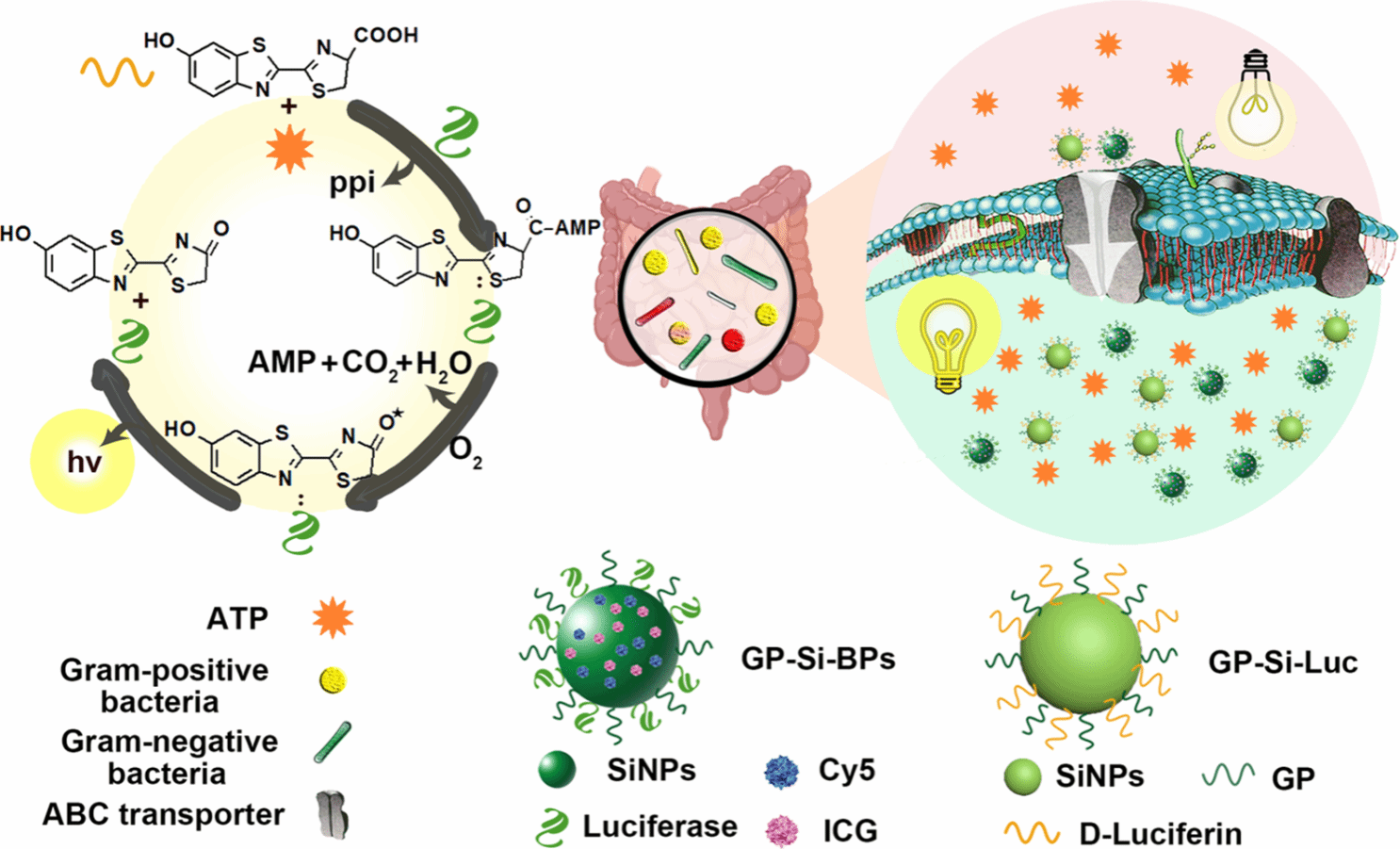
要点:
1.构建“特洛伊木马”探针:将荧光素酶、Cy5和ICG修饰的硅纳米粒子与GP偶联,构建GP-Si-BPs探针;将D-荧光素修饰的硅纳米粒子与GP偶联,构建GP-Si-Luc底物。
2.体外验证:利用流式细胞术和共聚焦激光扫描显微镜评估GP-Si-BPs和GP-Si-Luc对多种革兰氏阴性菌和革兰氏阳性菌的摄取效率,并证明其摄取机制是通过ABC糖转运蛋白途径。
3.体内成像:在小鼠细菌性肾炎和结肠炎模型中,利用GP-Si-BPs和GP-Si-Luc进行生物发光成像,并与其他成像方法进行比较,证明其高选择性和高灵敏度。
总结和展望:
本研究成功开发了一种基于“特洛伊木马”策略的BLI技术,利用细菌特异性ABC糖转运蛋白将荧光素酶和荧光素递送到细菌细胞内,实现了活细菌的体内可视化。该策略具有高选择性、高灵敏度、高穿透力等优势,并具有光热治疗潜力,为细菌感染的临床诊断和治疗提供了新的思路和方法。进一步优化探针设计,简化实验流程,降低成本,提高探针的稳定性和生物相容性。 将该策略应用于更多细菌感染模型,例如肺部感染、皮肤感染等,并探索其在其他疾病诊断和治疗中的应用。 将该策略与其他治疗方法结合,例如抗生素、免疫疗法等,提高治疗效果,并开发针对不同细菌感染的新型治疗策略。 将该策略应用于其他物质的细菌靶向递送,例如药物、基因等,为开发新型抗生素和基因治疗提供新的思路。 推动该策略的临床转化,使其能够应用于临床细菌感染的治疗,并最终造福患者。

