
Low temperature photothermal therapy: Advances and perspectives
低温光热治疗
①Thermoresponsive Nanogel-Encapsulated PEDOT and HSP70 Inhibitor for Improving the Depth of the Photothermal Therapeutic Effect
用于提高光热治疗效果深度的热响应纳米凝胶包封的PEDOT和HSP70抑制剂
论文信息:Dongdong Liu, Liyi Ma, Yanxin An, Yu Li, Yuxin Liu, Lu Wang, Jin Guo, Jianhua Wang。 Adv. Funct. Mater. 2016, 26, 4749–4759
DOI: 10.1002/adfm.201600031
②Polydopamine-coated nucleic acid nanogel for siRNA-mediated lowtemperature photothermal therapy
用于siRNA介导的低温光热治疗的聚多巴胺包被核酸纳米凝胶
论文信息 Fei Dinga, Xihui Gaob, Xiangang Huanga, Huan Gea, Miao Xiea, Jiwen Qiana, Jie Songc, Yuehua Lid,∗∗, Xinyuan Zhua, Chuan Zhang
Received in revised form 2 March 2020; Accepted 14 March 2020 Corresponding author.
③Engineering of a Nanosized Biocatalyst for Combined Tumor Starvation and LowTemperature Photothermal Therapy
用于肿瘤饥饿和低温光热联合治疗的纳米生物催化剂的工程
论文信息Jun Zhou,† Menghuan Li,† Yanhua Hou,§ Zhong Luo,*,†,‡ Qiufang Chen,‡ Hexu Cao,† Runlan Huo,† Chencheng Xue,† Linawati Sutrisno,‡ Lan Hao,∥ Yang Cao,∥ Haitao Ran,∥ Lu Lu,‡ Ke Li,‡ and Kaiyong Ca
DOI: 10.1021/acsnano.8b00309 ACS Nano 2018, 12, 2858−2872
主讲人:张雨璨,2024年9月14日
研究背景:
光热治疗(photothermal therapy,PTT)是利用光热转换剂(photothermal agent,PTA),在近红外光(near-infrared,NIR)等外部光源照射下,将光能转变为热能来杀伤肿瘤细胞的一种无创性肿瘤治疗新方法。PTA被特定波长的光照射时,吸收光子的能量,并从基态单重态活化为激发单重态。随后电子激发的能量经历一种非辐射形式的衰变-振动弛豫,通过PTA与周围分子之间的碰撞返回基态,增加的动能则使周围微环境升温。目前ptt按温度可分为传统的光热治疗(≥45°)和近年来应用愈加广泛的低温光热治疗LTPTT(<45°)。
研究内容:
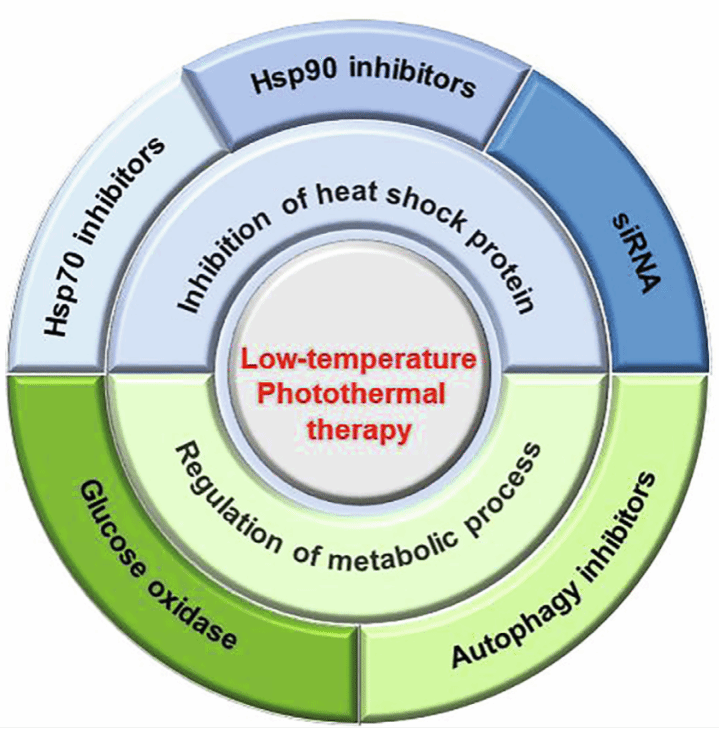
虽然对PTT的研究已经发展成熟,但预计将投入更多的努力来规避PTT固有的缺陷,如不能完全消除癌细胞——尤其是转移性肿瘤——以及需要将局部温度维持在50°C以上才能有效杀死癌细胞[30,31]。由于激光强度可随组织深度的增加而大大降低,一些耐热细胞需要较高的激光强度或延长照射时间才能达到理想的治疗效果。此外,由于非特异性加热和热扩散,除了消融肿瘤之外,强激光照射还不可避免地损伤癌细胞附近的健康组织。值得注意的是,上述问题可归因于热袜蛋白(Hsp)的保护作用,其可在面对热反应刺激时保护癌细胞。因此,非常需要能够解决PTT期间的高温问题并实现优异治疗功效的更温和的方法。温度低于45°C的低温PTT(LTPTT)在未来的发展至关重要。LTPTT的特点主要包括:影响一些蛋白质的活性;破坏细胞周期,导致细胞凋亡;改善肿瘤部位的PTA积累;减少对血管的不可逆损伤。我们主要关注热休克蛋白和代谢过程对PTT效率的影响。例如,使用Hsp抑制剂或葡萄糖氧化酶(GOx)直接下调Hsp的表达,这使得低温PTT(LTPTT)可实现。此外,由于自噬可被PTT或代谢激活;因此,抑制自噬是增强PTT治疗效果的另一种策略。在这篇综述中,我们总结了LTPTT的最新研究进展,并讨论了其在临床应用中的未来挑战。如图1所示,用于改善LTPTT功效的方法可分为两部分:(1)使用分别在分子水平和基因水平起作用的Hsp抑制剂或小干扰RNA(siRNA)抑制Hsp表达;(2)使用GOx和自噬抑制剂调节代谢过程可以间接降低Hsp水平。GOx可以消耗Hsp表达所需的能量,而自噬抑制剂可以使癌细胞对热处理更加敏感。最后,讨论了临床LTPTT中存在的挑战,并介绍了设计更有效治疗药物的未来前景
要点:
目前发展LTPTT的方法主要包括
1.抑制热休克蛋白(Hsp)的表达
2.调节细胞的代谢过程
总结和展望:
本次汇报总结了目前通过LTPTT来提高PTT治疗效率的主要方法。
目前大量工作聚焦于通过下调Hsp水平来阻断PTT过程中的热休克反应。提出的主要方法包括直接抑制Hsp表达和调节代谢过程:
(I)小分子Hsp抑制剂;(II)用于Hsp mRNA基因沉默的siRNA;(III)Hsp饥饿的ATP消耗;(IV)用于降低自愈能力的自噬抑制剂。
这些途径可以在一定程度上缓解PTT固有的局限性,未来有可能作为临床癌症治疗手段。然而,这些创新大多仍处于起步阶段,在临床转化方面的潜能也有待评估。

