细胞迁移和侵袭是生物学研究中常见的现象,也是疾病发展过程中重要的环节。细胞迁移/侵袭实验作为一种常用的生物医学实验,旨在评估细胞的侵袭和迁移能力,尤其是对细胞在模拟体内的生理环境下的行为进行模拟和观察,一般在肿瘤恶性化表型研究中最常见。因为在肿瘤治疗中,普遍认为抑制肿瘤细胞迁移和侵袭是有效的治疗手段。因此在对肿瘤细胞进行干预(过表达、敲低、敲除、点突变、药物处理)后对细胞的迁移与侵袭能力进行检测,可以作为评估干预效果的一个有效指标。
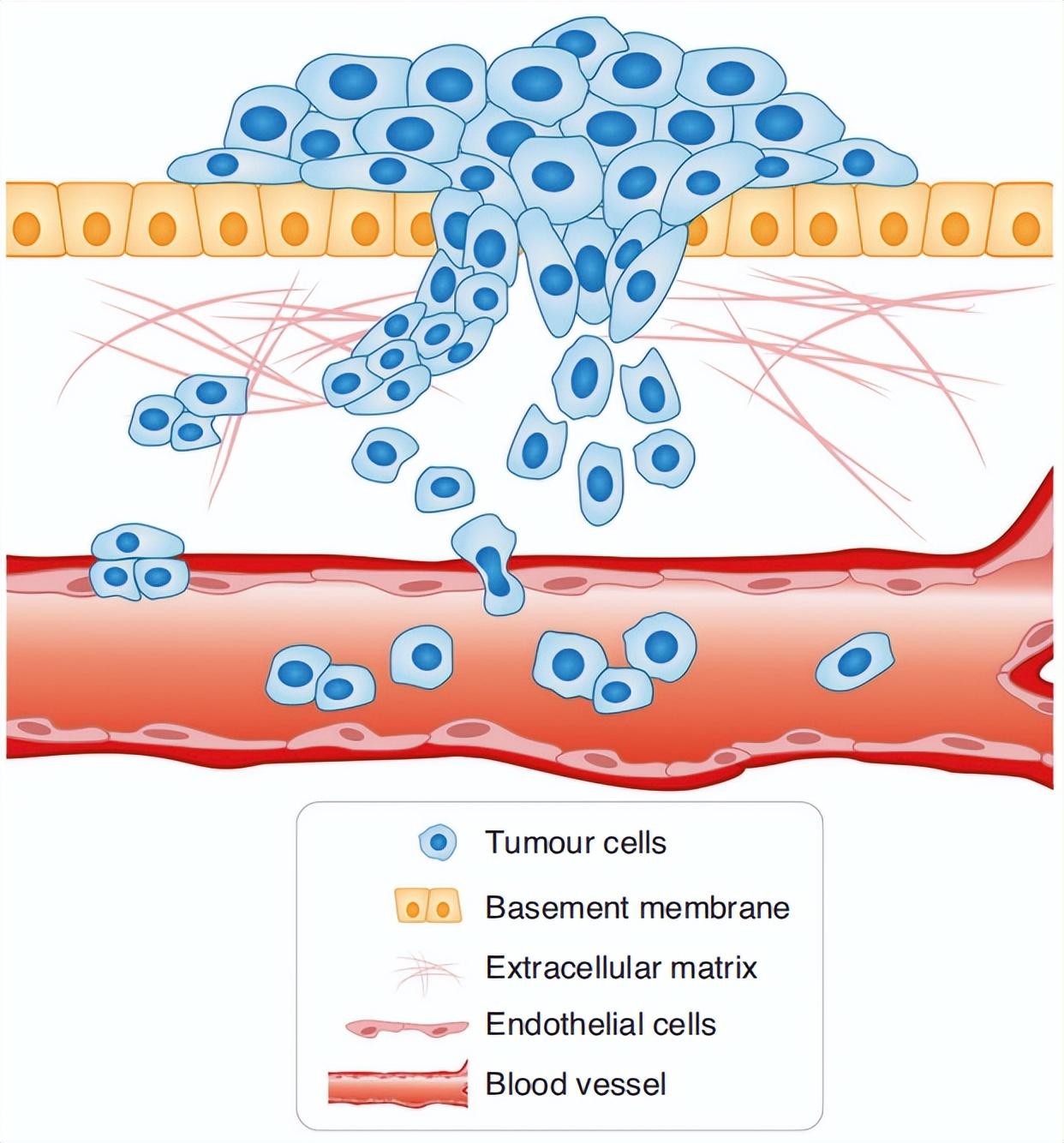
▲肿瘤细胞侵袭模型(Novikov et al., 2021)。
一、细胞迁移/侵袭简介
细胞迁移(Cell Migration)也称为细胞爬行、细胞移动或细胞运动,是指细胞在接收到迁移信号或感受到某些物质的梯度后而产生的移动。细胞迁移为细胞头部伪足的延伸、新的黏附建立、细胞体尾部收缩在时空上的交替过程。细胞迁移是正常细胞的基本功能之一,是机体正常生长发育的生理过程,也是活细胞普遍存在的一种运动形式。在胚胎发育、血管生成、伤口愈合、免疫反应、炎症反应、肿瘤转移等多个过程中都涉及到细胞迁移。由于转移性疾病是导致癌症死亡的关键因素,因此了解细胞迁移机制对于癌症研究至关重要。
细胞侵袭(Cell Invasion)是细胞迁移的一种,与细胞迁移密不可分,是指细胞在原位突破基底膜,然后内渗进入血管、淋巴管的过程,即入侵的细胞(如恶性肿瘤细胞)穿过胞外基质层(Extracellular Matrix,ECM)或基底膜基质层(BME)从一个区域侵入到另一个区域,在侵袭到新区域之前,ECM/BME被细胞内的蛋白酶降解。细胞侵袭常发生于伤口修复、血管形成和炎症反应以及组织的异常浸润、肿瘤细胞转移等过程中。因此,研究其中的机制对多种生理/病理过程都有着重要的意义。而肿瘤细胞的侵袭性是肿瘤相关信号通路、药物治疗、靶向治疗、致癌/抑癌基因等肿瘤学研究的一个重要指标。
检测细胞迁移能力最常见的方法是细胞划痕实验和Transwell小室检测,两者的区别在于细胞划痕简单经济,模拟单层细胞在2D平面的迁移;而Transwell成本较高,模拟细胞在3D空间的迁移。另外,Transwell也是检测细胞侵袭能力最常用的手段。
二、细胞划痕实验
细胞划痕实验(Scratch Assay or Wound Healing)是一种操作简单,经济实惠的研究细胞迁移的体外试验方法,类似体外伤口愈合模型,主要是用来检测细胞在2D空间中的一个迁移能力。是在体外培养皿或平板培养的单层贴壁细胞上,用微量枪头或其它硬物在细胞生长的中央区域划线,去除中央部分的细胞,然后继续培养细胞至实验设定的时间,依据划痕边缘细胞逐渐进入空白区域使“划痕”愈合的能力,判断细胞生长迁移能力。因其类似体外伤口愈合过程,又名伤口愈合实验。
基本原理:
当细胞长到融合成单层状态时,在融合的单层细胞上人为制造一个空白区域,称为“划痕”,划痕边缘的细胞会逐渐进入空白区域使“划痕”愈合,在一定程度上模拟了体内细胞迁移过程。
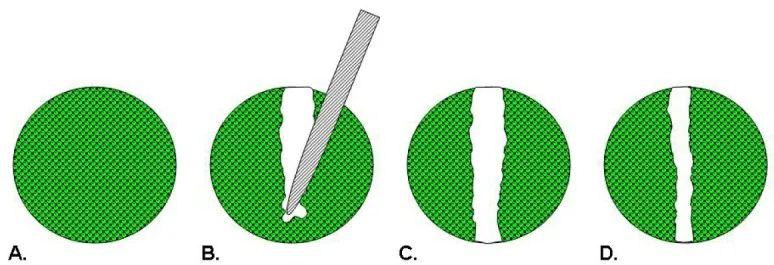
图1 划痕实验示意图(Hulkower et al., 2011)。
操作步骤:
培养板划线—铺板—细胞划线—清洗—细胞培养观察—结果分析
注意事项:
1、铺板时一般选择6孔板,因为6孔板大小适中,可保证有相当距离的平直划痕,便于观察。而且因为有5条定位线,与划痕相交,这样就有10个可固定监测点,不作重复,误差也很小。但是如果实验需要高通量初筛,也可以用12或24孔板。
2、实验时应注意细胞生长状况,选择适当的细胞接种浓度。对不同类型细胞要观察细胞贴壁率等,确定实验时细胞种板数量和培养时间,保证培养终止时密度适当。
3、减少细胞增殖对实验结果的影响,应选择加入无血清或血清浓度低(≤2%)的培养基进行细胞培养。
细胞划痕的优点:
1、操作简便,不需要借助特殊的实验仪器;
2、实验成本低。
细胞划痕的缺点:
1、操作者划痕易出现宽度不均一,影响划痕愈合度评估;
2、划痕会对周围细胞造成机械损伤,影响细胞活性;
3、不太好排除增殖带来的影响。
三、Transwell小室检测
Transwell顾名思义是“穿孔实验”,即将小室放入孔板中(常见的是24孔板),小室中含有密密麻麻的小孔,将细胞悬液加到小室中,小室放在加入完全培养基的24孔板内,细胞可通过形变穿过小室中的孔而跑到营养更丰富的小室外部并贴在外侧。通过对小室外部的细胞进行染色计数,就可以判断细胞的迁移与侵袭能力的强弱。
基本原理:
细胞迁移与侵袭实验就是将小室放入培养板中,小室内称为上室,培养板内称为下室,上下层培养液以聚碳酸酯膜相隔,上室内添加上层培养液,下室内添加下层培养液。将细胞种在上室内,由于膜有通透性,下层培养液中的成分可以影响到上室内的细胞,从而可以研究下层培养液中的成分对细胞生长、运动等的影响。
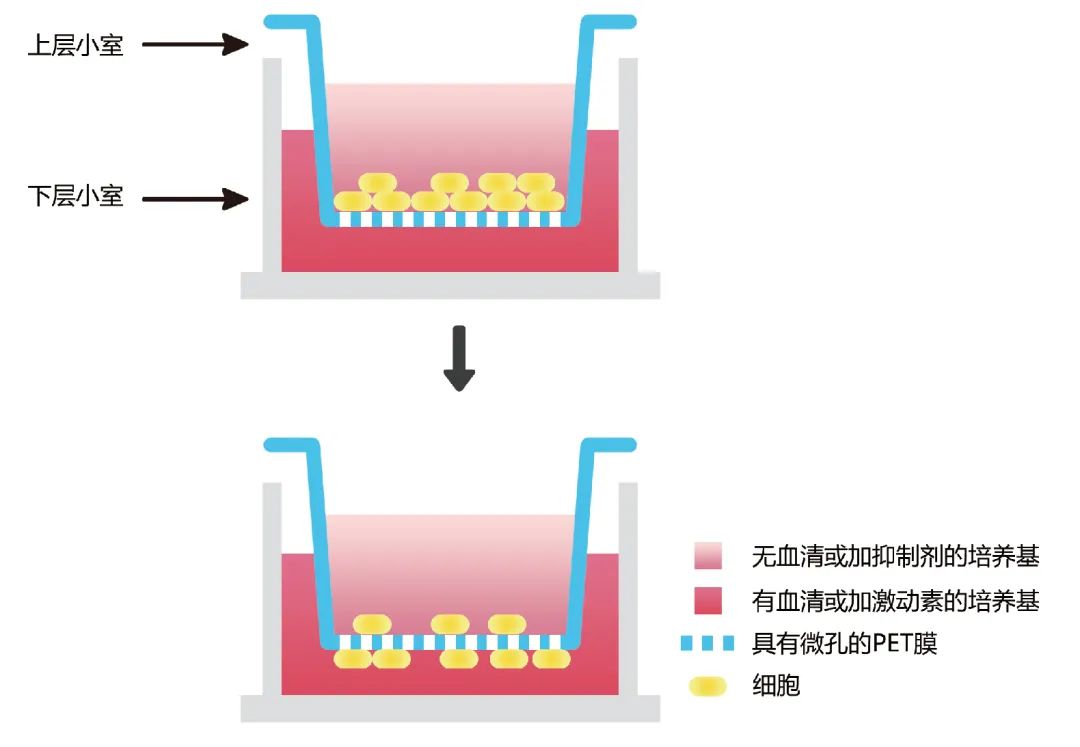
图2 Transwell实验原理图。
应用不同孔径和经过不同处理的滤膜,可进行共培养、细胞趋化、细胞迁移、细胞侵袭等多方面研究。由于不同细胞的体积不同,选择时需考虑到细胞大小。这里主要谈几种常用实验:
1、共培养体系
细胞在滤膜孔径小于3.0μm的条件下不会通过,因此,若研究不涉及细胞运动能力、不需细胞穿过滤膜时,则应选择3.0μm以下孔径。将细胞A种于上室,细胞B种于下室,可研究细胞B分泌或代谢产生的物质对细胞A的影响。
2、趋化性实验
上室细胞可穿过滤膜进入下室,计数进入下室的细胞量则可反映下室成分对上室细胞的趋化能力,详情如下:
(1)细胞B对细胞A的趋化作用:将细胞A种于上室,细胞B种于下室,研究细胞B分泌或代谢产生的物质对细胞A的趋化作用;
(2)趋化因子对细胞的趋化作用:将细胞种于上室,下室加入某种趋化因子,研究该趋化因子对细胞的趋化作用。
3、肿瘤细胞迁移实验
上室种肿瘤细胞,下室加入FBS或某些特定的趋化因子,肿瘤细胞会向营养成分高的下室迁移,计数进入下室的细胞量可反映肿瘤细胞的迁移能力。
4、肿瘤细胞侵袭实验
与肿瘤细胞迁移实验类似,但与肿瘤细胞迁移实验不同的是,上室需铺上一层基质胶(常用人工重构基底膜材料Matrigel)以模仿体内细胞外基质(ECM),细胞欲进入下室,先要分泌基质金属蛋白酶(MMPs)将基质胶降解,方可通过聚碳酸酯膜。计数进入下室的细胞量可反映肿瘤细胞的侵袭能力。
Transwell细胞迁移操作步骤:
细胞培养与处理—Transwell小室准备—制备细胞悬液—接种细胞至上方小室—细胞固定—细胞染色—封片—细胞观察计数
注意事项:
1、选择实验细胞时需保证细胞状态良好;
2、放入小室时,小心不要产生气泡。如果有气泡,请小心轻拍底板的侧面以清除气泡;
3、细胞固定时用棉签擦去未迁移细胞时需要控制力度务必小心,不要戳破底部膜,更不要擦去已穿膜的细胞;
4、对于难穿膜的细胞可以进行饥饿处理后再进行相关实验。
Transwell细胞侵袭操作步骤:
细胞培养与处理—包被基底膜—水化基底膜—制备细胞悬液—接种细胞至上方小室—细胞固定—细胞染色—封片—细胞观察计数
注意事项:
1、Matrigel是一种细胞外基质,4℃时是液体,在22-35℃时快速成胶,溶解时需在4℃冰上过夜冻融,所有用品在使用前需置于冰浴,必须使用预冷的移液管、吸头及小管操作Matrigel;
2、可将冻融后的Matrigel分装在多个小管,所有分装均需用预冷的冻存管,迅速冷冻并保存,避免多次冻融。
参考文献
Novikov N M, Zolotaryova S Y, Gautreau A M, et al. Mutational drivers of cancer cell migration and invasion[J].Br J Cancer 124, 102–114 (2021).
Hulkower KI, Herber RL. Cell migration and invasion assays as tools for drug discovery. Pharmaceutics. 2011;3(1):107-124

