一、标本采集和送检
(一)CSF标本采集
一般不需要抗凝,抽取后置于新的一次性容器内直接尽快送检。为了尽可能保持细胞活性,建议采集后加入带适量血清(0.2%小牛血清或者10%胎牛血清)的培养基中,或者特殊的细胞保存液中[17]。
(二)CSF标本转运和接收
CSF标本采集后应尽快送检,原则上采样后2~4 h内送达,最迟不得超过8 h,如使用特殊保存液可延长到18~72 h[1, 2,17]。标本送检时的运输温度以18~25 ℃为宜,不得高于25 ℃或者低于4 ℃。
标本接收时应注意核查以下几方面:(1)送检时间和运输温度;(2)标本容器和信息标识(条形码或标签):容器应无破损,标签应清楚,且与申请单一致;(3)标本的物理性状:样本量需大于等于1 ml,标本无凝集、浑浊或者明显血性;(4)离心浓缩时注意管底,如出现红色聚集可能提示穿刺损伤。
不合格标本应及时通知临床,并建议重新按照合格标本条件送检。如果不能重新获取标本,与临床沟通后确定进行检测,应并在结果报告中注明标本情况以及可能导致的结果不可靠性。
共识3 常规条件下采样后2~4 h内送达,最迟不得超过8 h,不能在8 h内送达的样本应放置在特殊保存液中运送。送检过程中,标本应保持18~25 ℃运输,不超过25 ℃,也应该避免低于4 ℃。推荐强度,强烈建议。
二、抗体选择与方案设计
(一)CSF标本常用的急性白血病检测标志
急性白血病的CSF累及极少为原发,一般都是髓外累及,故多属于微小残留病(minimal residual disease,MRD)检测[17, 18, 19, 20, 21]。
1.一般AML最低检测标志:包括CD34、HLA-DR、CD117、CD11b、CD14、CD33、CD64、CD7、CD56、CD19。少数情况下根据标本量选做标志:CD15、CD13、CD371、CD36、CD123、CD9、CD11c、CD300e、CD5、CD2、CD22、CD61或者CD42a等。如果是特殊亚型如急性巨核细胞白血病,做CD42a、CD61、CD42b检测。
2.B-ALL/LBL最低检测要求:包括CD34、CD10、CD20、CD38、CD19、CD22、CD13、CD33。少数情况下根据标本量选做标志:CD117、CD7、CD15、CD64、CD14、CD36、CD123、CD9、CD5、CD2、κ、λ、CD79b等。
3.T-ALL/LBL最低检测要求:包括CD34、CD99、CD1a、CD2、CD3、CD4、CD5、CD7、CD8、CD56,少数情况下根据标本量选做标志:CD10、T细胞抗原受体(T cell receptor,TCR)αβ、TCRγδ、TRBC1、CD13、CD33、CD117、CD19、CD22等。
(二)CSF标本的淋巴瘤检测标志
PCNSL极为罕见,大多数是NHL累及CNS,故MRD居多,但是有时候NHL的原发部位不易取材或者不易发现,故MRD和疾病筛查均有可能[21, 22, 23, 24, 25, 26, 27, 28, 29]。
1.B细胞淋巴瘤检测抗体分为3层:(1)必做抗体:CD5、CD10、CD19、CD20、CD38、k、λ;(2)次重要抗体:CD79b或者CD22、CD103,CD10+建议做CD34;(3)第3层抗体:CD23、FMC7、ki67、CD25、CD11c、CD138、CD180等,CD10+建议加做TdT,如果有浆细胞分化,需要加做ck、cλ、CD56。
2.浆细胞肿瘤检测抗体也分为3层:(1)必做抗体:CD19、CD20、CD38、CD56、CD138;(2)次重要抗体:ck、cλ、CD117、CD27;(3)第3层抗体:k、λ、CD229、ki67、cCD79a、CD81、HLA-DR、CD22或者CD79b等。
3.T细胞淋巴瘤检测抗体分为4层:(1)必做抗体:CD2、CD3、CD4、CD5、CD7、CD8、CD56、CD30、CD57、TCRγδ;(2)次重要抗体:TRBC1,CD4+淋巴瘤建议做CD10、CD279、CD25,CD4+/CD8+和CD4-/CD8-做CD1a、CD99、CD10、CD34,TCRγδ淋巴瘤建议做TCRVδ1和TCRVδ2;(3)第3层抗体:ki67、TCRαβ、CD26、CD45RA、CD45RO、CD103、CD117,CD4+/CD8+和CD4-/CD8-做TdT,CD3+/CD56+做CD158a、CD158b、CD158e等;(4)第4层抗体:TCRVβ全套检测。
4.NK细胞淋巴瘤检测抗体分为3层:(1)必做抗体:CD2、CD3、CD4、CD5、CD7、CD8、CD56、CD30、CD57;(2)次重要抗体:CD159a、CD159c、CD161、CD94、CD16、TCRγδ;(3)第3层抗体:ki67、CD117,CD158a、CD158b、CD158e、TCRαβ等。
(三)CSF标本的非造血系统肿瘤检测标志
上皮来源NHN的相对特异的标志主要有上皮角蛋白和CD326、CD227,神经肌肉来源的相对特异的标志主要有GD2(主要见于神经母细胞瘤和部分黑色素瘤)[9, 10, 11, 12, 13, 14,30, 31]。CD56是NHN最常表达的标志,结合NHN不表达CD45的特性。CD45-/CD56+组合在神经肌肉来源的NHN中敏感度是100%,上皮来源的肿瘤敏感度是71.5%,CD56阴性的NHN主要集中在非小细胞癌,这些一般表达上皮角蛋白和/或CD326、CD227[30]。需要注意的是,除了CD56以外,有些常见的血液标志也可以表达于NHN,如CD9、CD81、CD138、CD71、CD117、CD10、CD90、CD99、CD15、CD57、CD271、CD34、CD58、CD24、CD44、CD11b等。故临床工作中,NHN的诊断主要是诊断和鉴别诊断同步进行。
(四)CSF检测抗体组合
Bento等[1]的8色方案类似于van Dongen等[17]方案均采用一管法,都是很好的参考方案,但是为了避免肿瘤细胞异常丢失或者获得标志导致表达紊乱,也为了防止污染和细胞数过少、比例过低造成的偶然性,本专委会建议有条件的医院采用8色两管方案,并且除非两种标志出现之一即为异常(如T系表达CD1a或者CD34,B系表达CD13或者CD33),否则尽可能不使用鸡尾酒抗体(表1)。
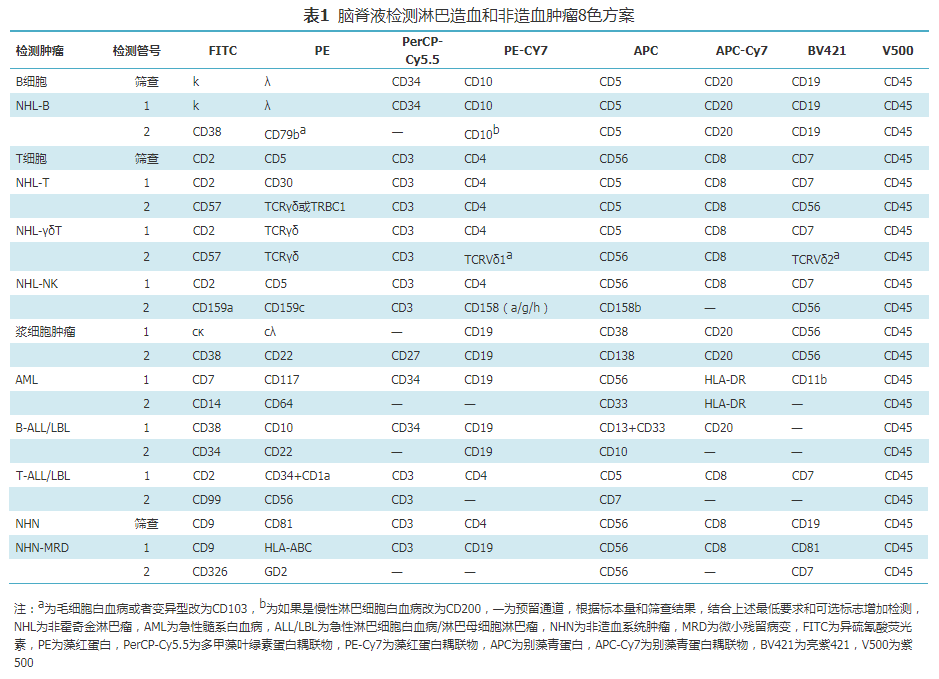
4色和6色方案检测CSF虽然有些难度,但是有些实验室目前还使用4色或者6色流式,故专委会对此也提出推荐方案见表2和表3。
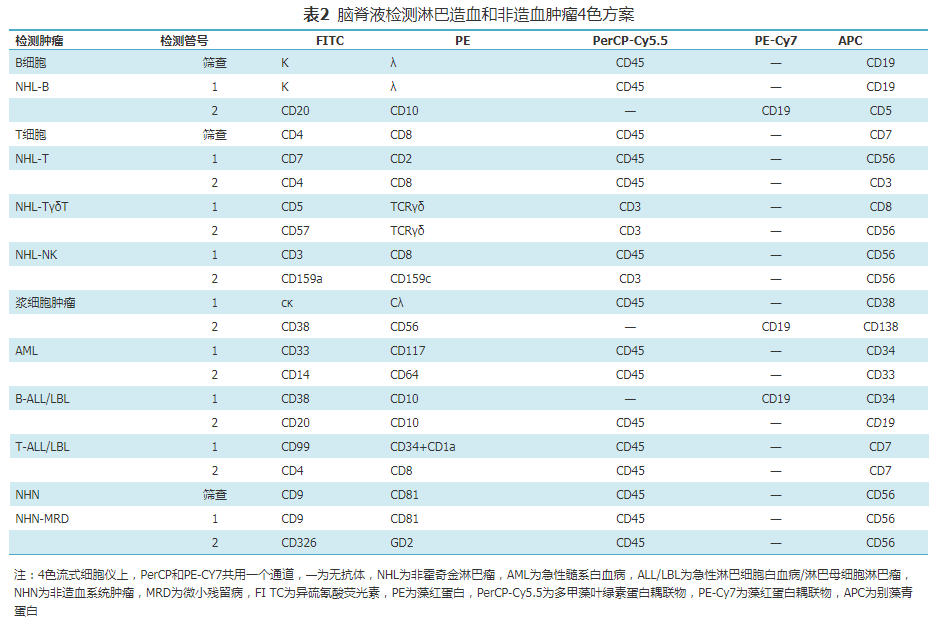
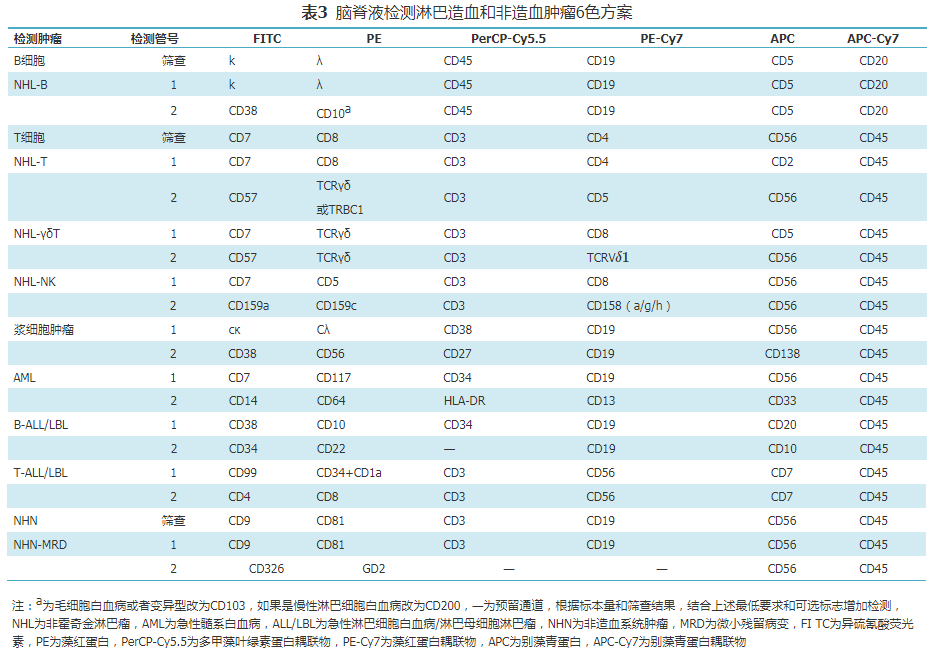
总之,抗体选择尽量采用推荐种类,组合设计因涉及各个实验室的仪器性能与临床信息,因此仅供参考,可以根据实际情况调整。
共识4 应根据确诊的疾病类型选择CSF标本的FCM检测标志;针对不同类型的造血和非造血系统肿瘤,CSF的FCM检测标志应满足前述最低检测要求,在此基础上可结合标本量和诊断需要选做推荐的一些检测标志。临床无提示的标本筛查同淋巴瘤,如出现伴随造血细胞标志表达,增加相应系别血细胞标志进行鉴别诊断,并根据标本量和筛查结果,结合上述最低要求和可选标志增加检测。临床有提示的病例和MRD、筛查方案见表1。推荐强度,建议执行。
共识5 建议有条件的医院采用8色两管方案,并且除非两种标志出现之一即为异常(如T系表达CD1a或者CD34,B系表达CD13或者CD33),否则尽可能不使用鸡尾酒抗体(表1);4色和6色方案检测CSF虽然有些难度,但有些实验室目前还使用4色或者6色流式,此时建议采用表2和表3方案。推荐强度,建议执行。
三、标本检测
(一)标本处理
收到标本后立即处理。取15 μl在显微镜下判断是否存在有核细胞:(1)一般情况下细胞量极少,离心后,使用移液器或者滴管小心弃上清,留总体积为200~300 μl备用;(2)如果细胞数量多,根据细胞数加入适量的带/不带0.5%(w/v)小牛血清的磷酸盐缓冲液(phosphate buffer saline,PBS),调整细胞浓度为1×107/ml备用。
注意,如果检测抗体为免疫球蛋白相关抗体(包括胞膜和胞浆、重链和轻链),标本需要前处理:(1)微量细胞标本,建议使用3 ml PBS带/不带0.5%小牛血清37 ℃孵育5 min,离心弃上清。然后按照标准步骤进行标记。(2)细胞量大的标本,按照标准方法处理,即加入3 ml PBS后混匀,37 ℃ 5 min孵育两次,洗涤3次。
(二)抗体标记
1.胞膜染色抗体:(1)根据确定的染色抗体及组合方案准备试管,并在试管上做好标记。(2)如果CSF细胞数量少,按照管数进行平均分配,留1管做备份。例如:一步法2管,则浓缩后标本均分3份,2份用于检测,1份做备份。如果是两步法检测,第一步2管筛查管用去一半标本。如果细胞量大,在每支试管中加入5×105~1×106细胞。(3)按照常规胞膜标记法操作,注意不许倒上清,一律用移液器或者滴管吸取上清。(4)一般不需要溶红细胞,如果是血性CSF,适当进行溶血处理。
2.胞膜和细胞内标志同时染色:按照不同厂家的说明书,先标记膜表面抗体,再破膜后进行胞浆抗体标记。
(三)流式细胞仪获取细胞
1.仪器的设置与调节:CSF标本的细胞数量少,严禁使用检测标本调整仪器条件,建议先根据仪器型号选择相应的仪器校准微球和正常淋巴细胞调整条件和补偿,然后使用相同或者相似方案的血液标本进行微调[32]。
2. 保持管道清洁无颗粒:CSF多因细胞数量少导致背景颗粒占比较高,故保持进样针和管道清洁,防止标本之间污染极为重要。除了按照厂家推荐的标准程序进行每日开关机清洁以及定期长清洗以外,每管标本上样之前均需用PBS做进样针冲洗,直到上PBS获取无颗粒,才能进行标本检测。
3. 获取细胞数量:由于CSF中细胞数量低,应从上样开始立即获取细胞,直到获完所有细胞,但是不要走空。
共识6 如果检测抗体为免疫球蛋白相关抗体(包括胞膜和胞浆、重链和轻链),标本需要做孵育、洗涤的前处理;获取过程中注意管道清洁。推荐强度,强烈建议。
四、免疫表型分析
(一)常用设门方法
通用设门:与血液标本相似,体液标本也一样需要前向角光散射面积/高度或者宽度设门排除黏连细胞、前向角光散射/侧向角光散射(side scatter,SSc)设活细胞门排除死细胞和碎片背景噪音,从单个活细胞门开始进行分析,需要CD45/SSc设门设定正常背景细胞群。只是包含的成分相对简单,一般情况下,正常CSF只有成熟淋巴细胞和单核细胞两群,淋巴细胞中T细胞为主(图1)。
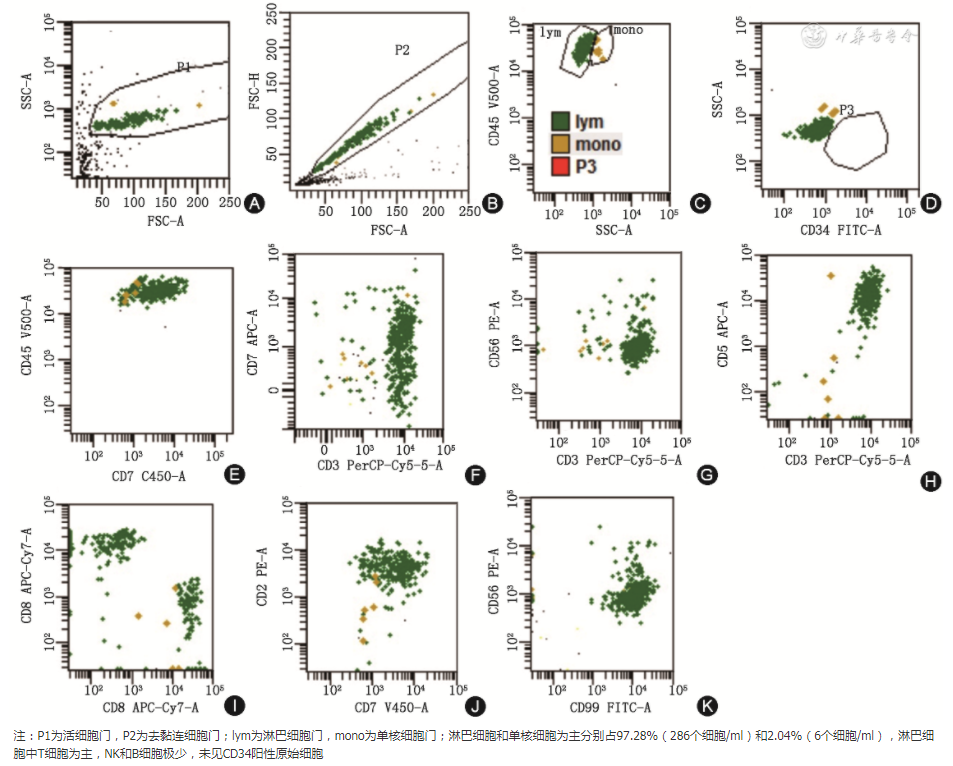
图1 正常脑脊液流式细胞图
需要注意的是,现在的临床流式检测基本上通过肉眼识别,而CSF细胞数量相对少,如果图片上代表颗粒的点显示过小,可能会漏掉有效细胞,因此建议分析软件中使用中等或者大图标显示,或者使用加重突出功能。
2.反向设门:CD45/SSc设门功能有限,在肿瘤细胞比例过低、细胞数量过少、背景颗粒过多、肿瘤细胞CD45/SSc表达与正常细胞如成熟淋巴细胞或者单核细胞重叠时,需要使用反向设门。一般情况下CSF分析都要求使用反向设门证实,即使用1个或者更多其他抗原标志(系别相关抗原或者分化阶段标志、细胞亚群标志等,或者标志的一部分)进行设门。如CD19/SSc设门观察B细胞,CD34/SSc设门看原始细胞。
3.序贯设门:低频细胞(如MRD)或者大量正常细胞掩盖少量异常细胞(如淋巴瘤)的时候,单独使用一种设门方法可能不能很好地识别肿瘤细胞,这时候会根据目的细胞群的性质,采用序贯设门(门内细胞再设门)的方法。CSF标本因为细胞相对单一,所以很少会用到,一般反向设门即可达到目的。
(二)结果报告
建议流式检测报告由文字和图片两部分组成,需包含如下信息。
1.文字说明:包括(1)一般信息:患者姓名、性别、年龄、医院、唯一号、临床诊断或者印象、标本类型、送检时间等;(2)检测信息:项目名称、使用的抗体组合(可以在图片中显示)、仪器、软件;(3)结果信息:如果见到肿瘤细胞,描述肿瘤细胞占有核细胞百分比、细胞数,抗原表达情况;如果标本中未见恶性细胞,描述正常各群细胞的百分比,以及各群细胞的亚群构成、表达情况;(4)结论:如果诊断明确,可以直接下结论,如肿瘤细胞比例、细胞数量、性质;如果未见肿瘤细胞,简单描述标本中所见,MRD结论为“本次检测范围内,未见恶性细胞”;(5)其他需要说明的信息:如果存在可能影响结果的标本质量问题或者做诊断需要附加的其他实验室检测或者临床信息,予以描述;(6)分析者信息:实验室名称、实验室地址、实验室电话、报告时间、检测人员姓名、报告人手写签名或者法律认可的电子签名。
2. 附带图片:采用彩色二维点图形式,用不同颜色将肿瘤细胞与正常各亚群细胞明显区分开,图片中建议带有背景细胞(通常为成熟淋巴细胞和单核细胞)作为内对照。
共识7 分析中为了避免漏掉细胞,建议分析软件中使用中等或者大图标显示,或者使用加重突出功能;检测报告应包括文字和图片两部分。推荐强度,强烈建议。
五、质量保证
(一)分析前质量保证
1. CSF标本的制备:CSF标本因为细胞数量少,细胞寿命短,很多实验失败是因为保存不当造成细胞活性差,操作不当丢失细胞,仪器不干净导致的交叉污染等。因此需要注意:尽早处理标本,操作时尽可能回收细胞(离心时使用尖底塑料离心管,去上清时用移液器或者吸管小心地吸取上清,严禁用CSF检测标本调节机器),上机前注意将仪器管道冲洗干净。
2. CSF保存液:实验室检测CSF的一个主要挑战就是标本中细胞会快速降解。采集后30 min细胞数就开始明显减少,使用保存液也许可以有效解决这个问题[1, 2,17],但是有待更多的研究证实。
(二)分析中质量保证
1.人员资质与培训:检测人员需经过上岗培训,具有相应能力。
2.设备与试剂:流式细胞仪按照厂家推荐每日和定期维护,开机日使用商业质控品进行校准并记录,通过效验才能使用。辅助设备至少每年一次送检至国家或者市级计量部门进行校准;试剂具有国家医疗器械分类管理要求的许可证;首次使用前进行有效性和特异性测定;按照说明书操作,如果改变厂家推荐用量应该进行浓度滴定证明效果优于厂家推荐;注意保质期内使用,并且注明开瓶日期,每半年至少有一次阳性结果验证抗体有效性;抽样进行批间运次间比对。
3.CSF检测重点:受细胞数量所限,重点在于找到肿瘤细胞,明确性质。对于亚型判断要求不高;CSF不存在原始幼稚细胞,故无需使用过多抗体进行良恶性鉴别。
4.其他细胞影响:有的CSF可能含有大量内皮细胞、死细胞和碎片,导致非特异性高,真假阳性鉴别困难,需要学会识别非特异性染色、内皮细胞、活化NK细胞、反应性浆细胞等一般CSF中很少见到的反应性细胞。
5.室内质控与室间质评:室内质控除了上述针对仪器和试剂的质控,还需半年一次进行人员比对、仪器比对、试剂比对、分析能力比对等,有的实验室购买商品化淋巴细胞亚群质控血做室内质控品。CSF目前未开展室间质控,目前建议参加国家卫生健康委临床检验中心室间质评和/或美国病理学家学会等国际实验室认证组织其他FCM项目的能力验证。在实验室标准化管理中,没有开展室间质评的项目可以用同行比对替代。但是鉴于目前CSF尚未成为FCM常规,开展CSF检测的实验室并不多,最重要的是CSF细胞数量极少,不论质控品制作还是同行比对,都受到极大限制。Kleine[32]研究表明,正常腰穿CSF与外周血相比,白细胞数是外周血的1/8 000左右,淋巴细胞数是外周血的1/2 000左右,也许将来可以考虑将现有的淋巴细胞亚群质控品稀释8 000~10 000倍作为CSF室间质控和同行比对的标本。
(三)分析后的质量保证
1.设门要求全面:流式细胞术检测的成败很大程度上依赖标志物。由于肿瘤的异质性和表达的不确定性,几乎没有哪一个标志可以覆盖一类肿瘤,尤其是近年来免疫靶向治疗的应用可能导致某些标志丢失,因此要求设门时采取多标志设门的方法。如B-ALL/LBL,除了常规CD45/SSc和CD19/SSc以外,要求同时使用CD34/SSc、CD10/SSc、CD22/SSc、CD45/CD19等设门,必要时检测方案增加CD24和/或CD229+/CD7-和/或CD81+/CD7-等作为设门标志。非造血系统肿瘤在这方面尤其明显,检测标志CD326、GD2、CD56等均需要与CD45组合观察。浆细胞肿瘤使用CD38靶向治疗后,必要时检测方案增加CD38多克隆抗体、VS38c和/或CD229+/CD7-作为设门标志。
2.禁忌只在CD45/SSc定义的各血细胞门内找肿瘤细胞:CD45/SSc设门定义的各造血细胞群是正常情况下,肿瘤时可以发生改变。最典型的是某些侵袭性淋巴瘤,经常不在淋巴细胞门内,因此禁忌只在淋巴细胞门内找淋巴瘤细胞,禁忌只在单核细胞门内找原始幼稚单核,以及只在原始细胞孔内找白血病细胞。
3.尽可能采用软件将全部细胞突出显示:流式细胞术检测灵敏度受软件限制,CSF因为细胞数量少尤其明显。因此要求除了100%显示细胞,还应该使用具有突出显示功能的软件。
4.细胞数对CSF阳性结果的影响:与骨髓不同,CSF细胞数量少,非特异性背景以及室管膜细胞等会影响总细胞数(分母),导致比例相对不可靠;细胞过少是影响FCM检测CSF特异性的主要因素。因此建议报告中除了百分比,还需要提供绝对计数,细胞数比百分比重要[3]。类似于MRD检测的最低检出限[22, 23],即可重复地定性鉴定MRD阳性细胞群体所需的最小细胞数,建议超过25个细胞认为是阳性,10~25个可疑,低于10个细胞认为是阴性[14,32]。
5.细胞活性与穿刺损伤的影响:CSF细胞活性低于30%认为无法进行分析。如果CSF标本中超过100个红细胞/μ1,考虑存在穿刺损伤(外周血污染)[33]。注意与穿刺损伤做鉴别,记录接到标本后肉眼观察情况(血性CSF可能提示穿刺损伤),以及初次离心浓缩时候管底是否存在红细胞(可能存在穿刺损伤)或者白细胞(可能为颅内感染)沉淀,必要时可能需要同时检测外周血标本。研究认为外周血标本阴性,CSF阳性时才能评价为CSF累及。儿童ALL的CSF检测中,穿刺损伤率可能会高达24%~45%[33]。
6.关于NK和T细胞单克隆性评价:CSF中一般很少有NK细胞,但是比例升高不一定是恶性,只是需要引起关注。CD159a、CD159c、CD158系列抗体的采用,有助于帮助判断NK细胞的单克隆性,但是灵敏度和特异性尚待探讨。T细胞淋巴瘤时,CSF很少能够做8管TCRVβ,所以有些实验室采用TRBC1代替[27, 28],还有的实验室将八管TCRVβ抗体加到一管里面,用来评价是否存在单克隆细胞。需要注意的是:(1)因为可能存在大量正常细胞做背景,单克隆性的评价需要注意精确设门;(2)单克隆性不等于恶性,NK和T细胞在特殊免疫状态时均可能有寡克隆性增殖,TCRVβ、TRBC1、TCRVδ1、TCRVδ2、CD158、CD159系列等出现一致性表达或缺失,需要综合考虑,尤其是比例低或者存在大量背景细胞的时候。
7.与临床及时进行反馈与沟通。
共识8 标本采集后需尽快送检,接收时注意合格标本的评价。根据诊断选择相应抗体组合或者筛查方案,尽量使用胞膜抗体替代胞浆抗体。由于正常CSF成分相对单纯,加上细胞数量限制,重点在于找到肿瘤细胞,明确性质。操作过程中注意尽早处理标本,尽可能回收细胞,并注意保持仪器管道洁净。分析过程中注意穿刺损伤和反应性细胞的影响。诊断报告中除了百分比,还需要提供绝对数,建议附带使用不同颜色设门标识不同细胞群的彩色二维点图。FCM的CSF检测,关键在于规范化操作,加强质量控制。推荐强度,强烈建议。

