(一)刮片细胞微生物学检查
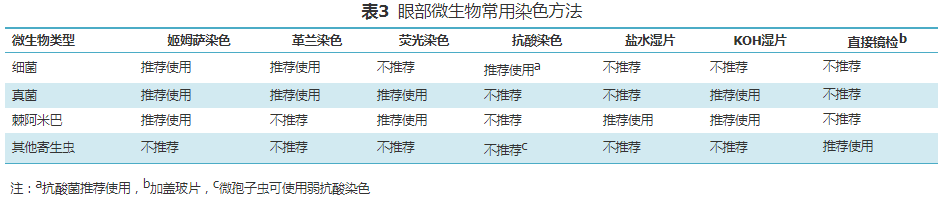
对于感染性眼病实验室诊断,除睫毛螨虫、阴虱或结膜吸吮线虫外,在培养、核酸及免疫学检测之前均应进行细胞微生物学检查,强调从病理学角度重视眼部刮片细胞学检查。刮片染色方法选择取决于临床拟诊及疑似的病原体类型。常用的染色方法包括姬姆萨染色、革兰染色、荧光染色和抗酸染色等。常用染色方法及检查对象见表3。
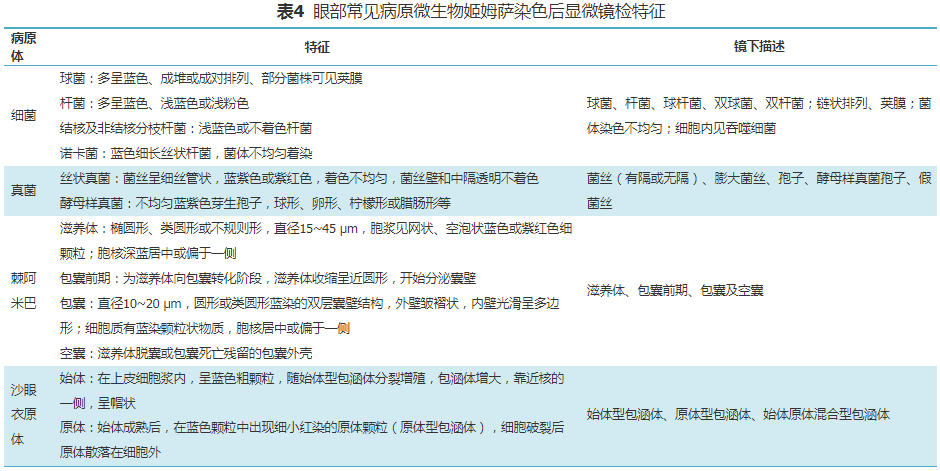
1. 姬姆萨染色:用于组织病理及病原体形态学检查,是眼科最常用的染色方法。根据病原体形态特征及排列方式可对细菌、包涵体、真菌、阿米巴等微生物进行鉴别,眼部常见病原微生物姬姆萨染色后显微镜下特征见表4。姬姆萨染色也可对病灶处的角结膜上皮细胞、炎性渗出细胞(中性粒细胞、淋巴细胞、嗜酸性粒细胞、单核吞噬细胞、浆细胞及肥大细胞等)以及特殊组织细胞进行观察。按照炎性细胞所占比例可判断感染还是非感染,急性感染(中性粒细胞为主)还是慢性感染(淋巴细胞增多);同时,不同微生物感染周围炎症细胞类型有所差异,如棘阿米巴感染可出现嗜酸性粒细胞浸润;衣原体感染急性期以中性粒细胞浸润为主,病毒感染则以淋巴细胞浸润为主,可出现细胞内包涵体。
2. 革兰染色:镜下描述同常规微生物检查。根据菌体形态(杆菌、球菌、球杆菌)、染色特性(阳性、阴性或不确定)、排列方式(成双、成堆或散在,短链或长链等)、白细胞吞噬等因素判断。如涂片见到大量中性粒细胞,细胞内外可见革兰阳性双球菌、呈矛头样相对排列、有厚荚膜,可报告疑似肺炎链球菌[28]。
3. 荧光染色:利用荧光素标记的几丁质酶可特异性结合真菌细胞壁的多糖及几丁质,5 min内快速判断标本中是否含有真菌成分。组织背景为均质黑色或弱蓝色荧光,真菌细胞壁则呈亮蓝紫色或明亮荧光蓝,容易识别菌丝或孢子形态、结构、菌丝密度等[29]。因棘阿米巴包囊同样含几丁质成分,包囊也可呈淡染的蓝绿色。荧光染色可显著提高对真菌、微孢子虫和棘阿米巴诊断的敏感性,但需注意拭子棉纤维以及任何含纤维素或几丁质的其他物质可能会造成假阳性。
4. 抗酸染色及弱抗酸染色:抗酸染色可对眼部抗酸菌,主要包括结核分枝杆菌(M. tuberculosis,MTB)、非结核分枝杆菌(nontuberculoaus mycobacteria,NTM)进行检测。疑似诺卡菌感染或微孢子虫可使用弱抗酸染色,菌体或虫体呈粉红色着染为阳性。
5. 湿片法:常用的方法有生理盐水湿片法和KOH湿片法,其中生理盐水湿片法主要用于棘阿米巴滋养体和包囊的活体观察,尤其适用于观察滋养体的运动情况。棘阿米巴滋养体在角膜组织间移行,呈不规则、易变化等特点,其胞质内富含颗粒物质,可随滋养体的变形而运动。囊前期包囊双层囊壁尚未形成,胞质内含有均匀的较粗大颗粒状物,较活跃,不停颤动。成熟包囊具有内外囊壁双层结构。空囊则呈皱缩状、无内容物,常见于抗阿米巴治疗后。KOH湿片法也可用于丝状真菌的观察,将采集的标本混匀涂于滴有10%~20%KOH溶液的清洁载玻片上,加盖玻片,过酒精灯火焰2~3次,冷却后低倍镜观察。KOH可消化组织细胞,使真菌菌丝清晰可见。
6. 寄生虫检查:除棘阿米巴原虫外,常见眼部寄生虫还包括结膜吸吮线虫、睫毛的螨虫及阴虱。结膜吸吮线虫生长于结膜囊内,裂隙灯下可见白色线头样虫体蠕动,镊子取出光学显微镜下进行观察。螨虫位于睫毛毛囊内,光学显微镜下(100倍)寻找蠕形螨成虫、幼虫或虫卵。阴虱常生长于睫毛毛根及毛干,裂隙灯下剪除或拔取睫毛后光学显微镜下观察成虫及虫卵,容易诊断。
(二)传统微生物培养
1. 培养基:眼部微生物常规培养包括需氧、兼性厌氧、厌氧及真菌培养等,必要时可增加微需氧及分枝杆菌培养。常用培养基包括哥伦比亚血琼脂、巧克力琼脂,必要时增加麦康凯、沙保罗、马铃薯及厌氧血琼脂培养基。强调厌氧培养的重要性,同时眼微生物医/技师需与临床医师密切沟通,对来之不易的标本尽可能全面进行有助于诊断的检验项目。
2. 培养条件:生化培养箱适用于不同温度下生长的细菌及真菌的培养,一般情况下,细菌培养温度34~36 ℃,2~5 d;真菌培养温度27~29 ℃或34~36 ℃,7~30 d。细菌培养的环境包括需氧、厌氧(厌氧袋、厌氧罐及厌氧手套箱),5%~7%CO2培养箱,微需氧等;除常规哥伦比亚血琼脂培养3~5 d外,分枝杆菌的生长需要罗氏或米氏7H10培养基以及BACTEC MGIT培养系统,7 d后观察生长情况,培养最长需56 d。眼部真菌适合马铃薯葡萄糖琼脂培养基或沙氏培养基斜面,每日观察,刮片/涂片呈阳性但培养为阴性、怀疑罕见或生长缓慢真菌应延长观察期至4~8周。
3. 关于增菌:眼部感染标本不建议增菌,尤其来自与外界相通部位分泌物,如结膜、泪道、泪囊。术中取材的房水、玻璃体液及角膜等可进行增菌。
4. 微生物鉴定:基于菌落的生化试验、自动化仪器及MALDI-TOF质谱是目前常用的鉴定手段,后者无论针对细菌还是真菌均可实现快速鉴定。必要时可选用rDNA(16S、18S或28S)及ITS/D1D2测序技术进行鉴定。
5. 抗菌药物敏感实验:国内基本选择临床实验室标准化协会(clinical and laboratory standards institute,CLSI)标准[30],但眼科多局部用药,其局部暴露剂量远高于血清药物浓度,抗菌药物敏感实验(antimicrobial susceptibility testing,AST)结果仅供参考。对外眼标本,有时无法鉴别分离菌株为共生菌群、污染或感染真正病原体,除凝固酶阴性的葡萄球菌(非路邓葡萄球菌)和类白喉棒状杆菌外,对单一微生物纯培养或培养出2种优势病原体,需行鉴定和AST(金黄色葡萄球菌和铜绿假单胞菌无论菌落多少,均应行鉴定和AST)。相较之下,内眼标本应作为无菌部位处理,任何培养阳性病原体皆需鉴定和AST。如果CLSI缺少某种抗菌药物的判定标准,可参考本地流行病学结果用药。
(三)棘阿米巴培养及鉴定
棘阿米巴性角膜炎多由棘阿米巴原虫感染所致,偶有耐格里属感染的报道。角膜棘阿米巴原虫的培养常规选择Page非营养琼脂培养基,其固体培养基可在100 ml液体培养基中加入1.5 g琼脂。在使用Page非营养琼脂培养基前,应在其琼脂表面涂布活的或灭活的大肠埃希菌菌液,标本点种于琼脂中心,置于湿盒内28 ℃孵育,每天观察,至少观察至第10 d。棘阿米巴可自琼脂表面接种部位生长并向四周移行,产生不规则轨迹,培养1 d即可在显微镜下观察到,接种5~10 d后可通过肉眼观察发现琼脂表面出现菲薄波纹状改变,低倍镜下见到小圆形或多边形壁厚包囊,折光性强;滋养体呈圆形、椭圆形、不规则等形态,并向四周移行觅食,所以接种部位的远端则以滋养体居多。用小刀片切取一片表面琼脂,在显微镜的油镜下观察,可清晰分辨出棘阿米巴滋养体和包囊的形态、结构。因抗阿米巴药物有限,临床上无需常规开展抗棘阿米巴药物敏感试验,在新药研发时可采用微量稀释法。
(四)核酸检测
目前尚无国家药品监督管理局批准的眼部标本核酸扩增检测试剂,大部分核酸检测采用实验室自行建立的方法,对常规培养阴性的标本,核酸检测成为诊断病毒性角膜炎、葡萄膜炎和视网膜炎的主要手段。利用实时定量PCR(quantitative real-time PCR,qPCR)技术检测腺病毒、巨细胞病毒、单纯疱疹病毒、水痘带状疱疹病毒、EB病毒和弓形虫等病原微生物已在业界达成共识[31, 32]。该方法特异度和敏感度较高[33],可通过拷贝数评估感染现状和治疗效果,其阳性预测值和阴性预测值优于传统微生物检测方法[34]。qPCR技术适用于急性感染期,恢复期或一过性感染,可出现假阴性结果[35]。此外,可利用16S rDNA和18S rDNA测序技术提高检出率。2017年,荧光原位杂交技术(flourescence in situ hybridization,FISH)首次用于眼科,利用葡萄球菌特异性分子肽核酸(peptide nucleic acid,PNA)探针进行肽核酸荧光原位杂交(PNA-FISH),20 min即可实现眼内液病原体检测[36]。近期,有研究扩大了FISH与PNA探针的应用范围,可快速检测眼内炎或角膜炎的常见细菌和真菌病原体(敏感度97%、特异度100%)[37]。对核酸检测标本,无菌取材后,应立即放置于封闭的灭菌容器中(如耐低温的冻存离心管)。对于需检测RNA的标本,应放置于冰盒内送至实验室,48 h内完成RNA的提取;需检测DNA的标本,可常温保存,但不能超过72 h,否则需-20 ℃或-80 ℃低温保存;另外避免标本反复冻融对蛋白样品的破坏。
对于眼部无菌标本,常规检验无法满足实验室诊断时,可选择宏基因组下一代测序技术(metagenomics next generation sequencing,mNGS)。该技术的无偏倚性使其成为未知病原体识别的重要手段[38]。有研究表明mNGS诊断眼内炎的敏感度为88%,在鉴定未知低丰度微生物时,mNGS灵敏度优于其他方法[39]。但mNGS受标本量、标本处理、核酸提取、文库制备及测序深度的影响,结果的准确性和特异度有待临床进一步验证。非无菌部位眼科标本可检测出多种微生物,临床上难以判断其是否致病。尽管mNGS存在局限性,但目前仍是眼科难培养病原体的检测手段之一。
(五)免疫学检测
继发于全身感染的视网膜炎或葡萄膜炎患者可进行血清学检查,如梅毒螺旋体、刚地弓形虫和伯氏疏螺旋体等的诊断。血清、房水、玻璃体液及泪囊分泌物均可进行病原体(包括疱疹病毒、巨细胞病毒、弓形虫、梅毒)特异性抗体和总IgG检测,方法包括酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)、免疫荧光法(immunofluorescence assay,IFA)及免疫印迹法(immunoblotting test,IBT)等。标本采集时机对结果解释非常重要,当IgG抗体恢复期较初期增高4倍或显著增高,且急性期显著增高可判断为阳性。有文献报道初次感染弓形虫后,IgM和IgA在感染后7~14 d达高峰,IgG在感染14~21 d开始上升并持续较长时间。IgM阳性对早期感染的诊断具有一定意义,IgG恢复期4倍高于急性期有回顾性诊断意义。通过计算Goldmann-Witmer(GW)系数,可辅助判断眼内该特异抗体是眼内原位产生,还是因为血清渗漏出现的假阳性。系数≥4表示局部抗体的产生,系数<2表示局部抗体的缺失,2~3取决于临床情况[27]。另外,抗体的检测与患者的免疫状态有关,免疫功能正常者若血清学检测结果阴性可排除感染;而免疫功能低下者,其抗体合成能力有限,出现假阴性需谨慎解释免疫学结果。抗体的产生还与自身抗体、补体及免疫抑制剂使用有关,因此结果解释必须结合临床。多项研究证实,联合应用GW系数、免疫印迹法和PCR,诊断的特异度高于99%。

