The role of lysosomes in metabolic and autoimmune diseases

溶酶体是分解代谢细胞器,通过自噬促进细胞内成分的降解,并通过内吞作用、吞噬作用和巨胞作用促进细胞外成分的降解。它们在分泌机制、细胞外囊泡的产生和某些细胞死亡途径中也起作用。这些功能使溶酶体成为细胞稳态、代谢调节和对环境变化(包括营养应激、内质网应激和蛋白质平衡缺陷)的反应中的中心细胞器。溶酶体在炎症、抗原呈递和维持长寿命免疫细胞方面也起着重要作用。它们的功能受到通过TFEB和TFE3的转录调节以及导致mTORC1和mTORC2激活,溶酶体运动和与其他区室融合的主要信号通路的严格调节。溶酶体功能障碍和自噬过程的改变已在多种疾病中发现,包括自身免疫、代谢和肾脏疾病。自噬失调可导致炎症,据报道,免疫细胞和/或肾细胞中的溶酶体缺陷在炎症和自身免疫性疾病中受累。溶酶体活性缺陷也已在蛋白质平衡紊乱的几种病理中被鉴定出来,包括自身免疫和代谢疾病,如帕金森病、糖尿病和溶酶体贮积病。因此,靶向溶酶体是一种潜在的治疗策略,可以调节各种病理中的炎症和代谢。
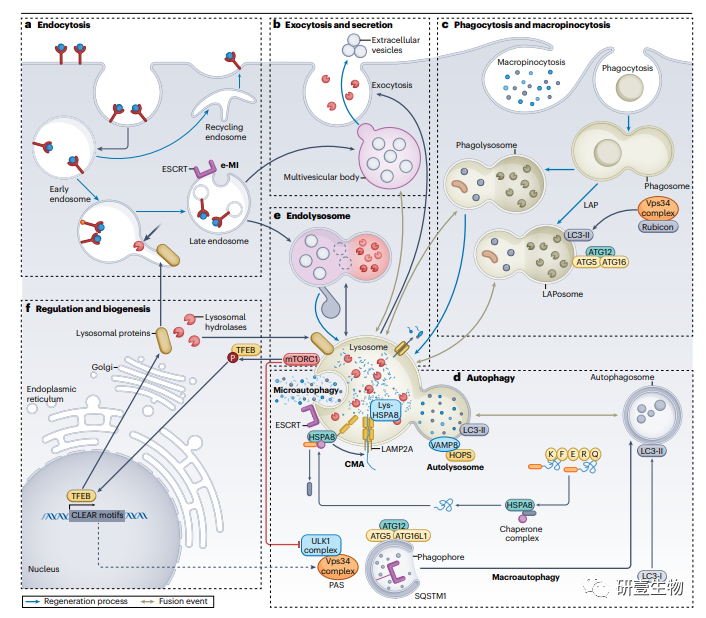
溶酶体是分解代谢细胞器,通过内吞作用、吞噬作用或微吞噬作用降解细胞外物质,通过自噬过程降解细胞内物质。胞吞作用是一种囊泡介导的过程,能够摄取细胞外物质并输入质膜结合分子。由此产生的早期核内体可以成为再循环核内体,将受体重新引导到质膜上,或者晚期核内体与溶酶体融合形成内溶酶体室或多泡体。内体微自噬(e-MI)使胞质物质进入内体。这个过程需要运输所需的内体分选复合体(ESCRT)机制。
溶酶体胞吐可在质膜修复过程中发生,并使溶酶体水解酶在局部释放。溶酶体也能与多泡体融合,形成细胞外小泡进行分泌。
吞噬作用可以通过形成吞噬体将大颗粒内化,而巨噬作用可以通过形成巨噬小体获得可溶的细胞外分子。吞噬体或巨溶酶体与溶酶体融合使其内容物降解。在微管相关蛋白轻链3 (LC3)相关吞噬作用(LAP)中,吞噬体被LC3修饰形成LC3小体。
溶酶体也可以通过自噬过程降解细胞内物质。巨噬是由吞噬体组装位点(PAS)的ULK1和Vps34复合物的激活引发的,这导致双膜吞噬体的形成。雷帕霉素(mTOR)复合物1的机制靶点(mTORC1)可以磷酸化ULK1,从而抑制巨噬。ATG5-ATG12-ATG16L1复合物的作用和脂化LC3蛋白(LC3- ii)的整合使膜伸长,膜关闭形成自噬体。LC3-II整合还可以与SQSTM1等货物选择蛋白结合,并使自噬体与溶酶体融合产生自溶酶体。HOPS复合物和VAMP8也参与了融合事件。具有KFERQ基序的蛋白底物直接易位到溶酶体可以通过伴侣介导的自噬(CMA)发生。这一过程需要底物蛋白与伴侣HSPA8结合。通过与溶酶体相关膜蛋白2A (LAMP2A)的结合介导复合体易位进入溶酶体。
溶酶体膜是通过内体、吞噬体或自溶酶体提供的膜的再循环产生的。原溶酶体小管从这些腔室中伸出,分离,并可以融合形成新的溶酶体。
溶酶体蛋白可以从高尔基体运输到早期内体或溶酶体。溶酶体膜蛋白、管腔蛋白和核心自噬相关(ATG)蛋白的表达受转录因子EB (TFEB)的控制,转录因子EB结合其靶基因启动子中的溶酶体协调表达和调控(CLEAR)基序。TFEB的活性是通过细胞质和细胞核之间的穿梭来调节的。在营养丰富的条件下,mTOR磷酸化TFEB并将其隔离在细胞质中,阻止基因转录。能量应激条件下mTOR的失活导致TFEB的去磷酸化,使其易位到细胞核。因此,mTORC1通过调节ULK1复合物控制TFEB诱导的溶酶体活性以及自噬起始。
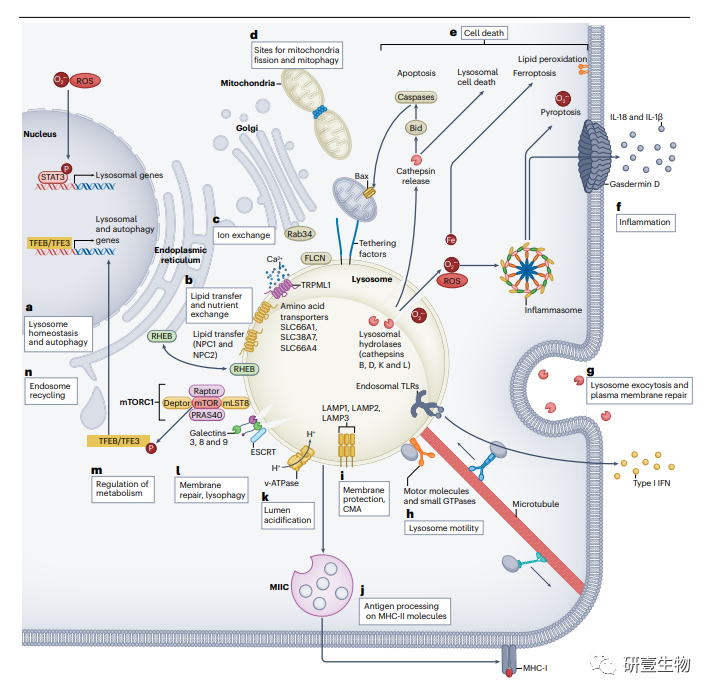
雷帕霉素(mTOR)复合物1 (mTORC1)介导的转录因子EB (TFEB)磷酸化和转录因子结合到IGHM增强子3 (TFE3)导致溶酶体蛋白和ATG基因的转录。受损溶酶体释放活性氧(ROS)触发信号换能器和转录激活因子3 (STAT3)的激活,也导致编码溶酶体蛋白的基因的转录。
在溶酶体膜上表达的转运蛋白使脂质、氨基酸和离子与其他细胞器如线粒体、内质网(ER)和高尔基体交换。
与线粒体接触的位点已被证明产生线粒体裂变的标记。
溶酶体膜损伤可释放组织蛋白酶和ROS进入细胞质。组织蛋白酶释放可导致溶酶体细胞死亡。或者,组织蛋白酶可以切割Bid并启动细胞凋亡的内在途径。ROS可诱导脂质过氧化,与游离铁积累一起导致铁死亡。
ROS还能激活NLRP3炎性小体,导致炎症和焦亡。溶酶体向细胞外围运动可导致其胞外分泌,这在质膜修复和水解酶的局部释放中起作用。
溶酶体在其膜上表达运动蛋白动力蛋白、驱动蛋白和小GTP酶。沿着微管的运输使溶酶体能够在核周定位和细胞外周之间穿梭,核周定位有利于与内质网、高尔基体和线粒体的交换,细胞外周定位有助于与质膜受体(如生长因子受体)紧密接近,并有利于胞吐和质膜修复。
溶酶体相关膜蛋白1 (LAMP1), LAMP2和LAMP3是溶酶体糖萼的组成部分,它保护溶酶体膜的管腔侧免受溶酶体酶和低pH条件的降解。在伴侣介导的自噬(CMA)中,LAMP2A在从细胞质到溶酶体腔的蛋白质易位中起作用。
内溶酶体参与MHC II类区室(MIIC)的产生,因此是抗原加工和递呈的组成部分。溶酶体的酸性环境是通过液泡型atp酶(v- atp酶)的作用维持的,它使质子能够进入管腔。所产生的酸性pH值使溶酶体水解酶的活性和溶酶体内容物的降解达到最佳状态。来自运输所需的内体分选复合体(ESCRT)复合体和来自凝集素家族的蛋白质可以被招募到受损的溶酶体膜上,分别导致膜修复或溶酶体通过溶噬降解
信号复合物如mTORC1和mTORC2位于溶酶体膜的细胞质侧。转录因子TFEB和TFE3在细胞质和细胞核之间穿梭调节自噬相关转录物的表达和溶酶体的稳态。mTOR激酶位于溶酶体膜上,是调节细胞生长、代谢和自噬的中枢。溶酶体的核周定位有利于溶酶体再生,通过内质网小管形成的内体循环。
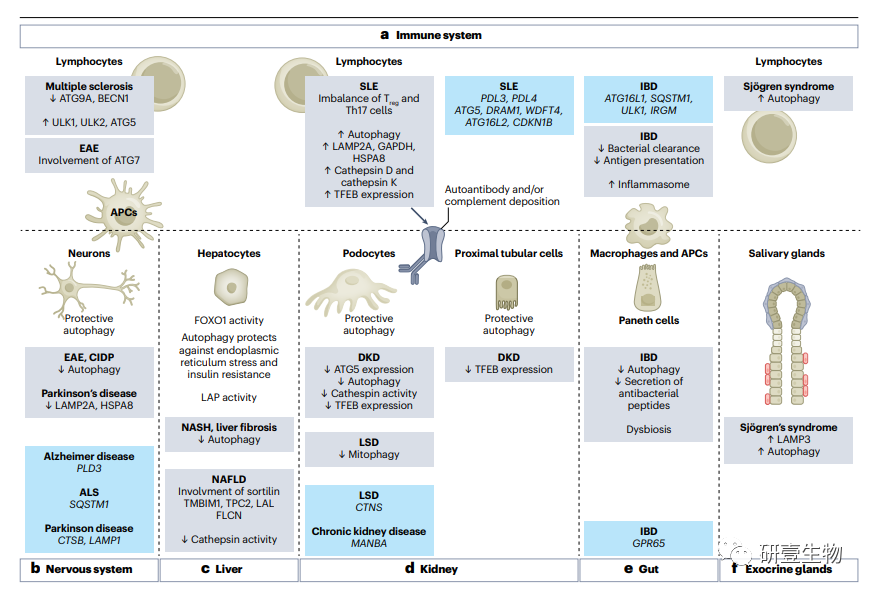
溶酶体活性的失调已在自身免疫性疾病、代谢疾病和肾脏疾病等病理中得到证实。免疫细胞中自噬和溶酶体过程的改变与多种器官的炎症有关。免疫和非免疫细胞中自噬的失调以及溶酶体和/或自噬相关(ATG)蛋白表达的改变已在多种疾病中得到证实,包括多发性硬化症、实验性自身免疫性脑脊髓炎(EAE)、系统性红斑狼疮(SLE)、炎症性肠病(IBD)和Sjögren综合征。
在SLE中,调节性T (Treg)细胞和Th17细胞的失衡与T细胞自噬的激活有关。据报道,在IBD中,自噬介导的细菌清除减少,抗原呈递受损和炎性体活化增加。
神经元和其他终末分化的长寿命细胞具有强烈的组成性自噬活性。在肌萎缩性侧索硬化症(ALS)、阿尔茨海默病和帕金森病等神经退行性疾病中,溶酶体活性限制了蛋白聚集体的积累,在中枢神经系统炎症性病变如EAE和慢性炎症性脱髓鞘性多神经病变(CIDP)中,自噬失调已被描述。
在肝细胞中,叉头盒蛋白O1 (FOXO1)诱导ATG基因,从而通过激活自噬促进脂滴的分解。此外,自噬可以防止内质网应激和胰岛素抵抗,而微管相关蛋白轻链3 (LC3)相关吞噬(LAP)也被报道可以防止肝纤维化。在非酒精性脂肪性肝病(NAFLD)和非酒精性脂肪性肝炎(NASH)等肝脏疾病中已经描述了溶酶体蛋白的异常表达和自噬活性的变化。
在肾脏中,肾小球细胞包括足细胞具有高水平的基础自噬活性。自噬在足细胞中具有保护作用,特别是在糖尿病肾病(DKD)期间暴露于晚期糖基化终产物(AGEs)诱导的应激条件下。
在影响肾脏的溶酶体贮积病(LSD)中,已在足细胞中描述了溶酶体损伤、导致蛋白质聚集体形成的蛋白质静止缺陷和线粒体自噬缺陷。在急性肾损伤中,近端小管上皮细胞自噬的保护作用已被报道。在SLE和DKD中,自身抗体和/或补体沉积可损害肾小球上皮,导致溶酶体胞吐、活性氧和AGEs的产生和慢性炎症。据报道,在DKD中足细胞自噬、组织蛋白酶活性以及转录因子EB (TFEB)和ATG5的表达减少。在肠道中,Paneth细胞中的溶酶体缺陷已被证明会损害抗菌肽的分泌,并导致IBD的生态失调。
据报道,Sjögren综合征中外分泌腺自噬活性的改变。在本病患者中,自噬活性在小唾液腺的T细胞区增加,而在继发性Sjögren综合征的MRL/Lpr小鼠模型中,自噬活性在淋巴器官过度激活,在唾液腺下调。几种自噬标志物和参与唾液腺上皮细胞凋亡和唾液分泌相关蛋白表达的LAMP3的表达改变,提示该疾病小鼠模型存在溶酶体缺陷。
虽然溶酶体含有60多种不同的酶,表达50多种膜蛋白,但特异性的溶酶体标记物极其罕见。这种困难可能与溶酶体的多功能性、适应性和动态行为有关,溶酶体具有重要的功能,并受到持续的压力。目前用于识别溶酶体的许多标记在内溶酶体途径的几种类型的结构中表达,或者是酸性囊泡的指示物。例如,LAMP3在晚期核内体中表达,但也是体外定量诊断ige介导的过敏的嗜碱性粒细胞激活的良好标记物。LAMP1主要在溶酶体中表达,但也可以在细胞表面表达,HSPA8在细胞质和质膜以及溶酶体中大量表达。最有效的溶酶体标志物之一是LAMP2A,它作为CMA底物的受体,通过使CMA在溶酶体膜上易位来决定CMA的活性率。LAMP2基因的其他剪接变异蛋白LAMP2B和LAMP2C不是cma6的标记。一种基于组织蛋白酶d结合肽pepstatin A的荧光性、细胞渗透性sir溶酶体探针已经被开发出来。这种商业探针染色活细胞中的活性水解酶,对溶酶体和晚期内溶酶体融合产物具有特异性。
另一个需要进一步研究的领域是与蛋白质消化有关的溶酶体活性的精细调节。在单个细胞内,一些溶酶体容易发生CMA,而另一些则不活跃。此外,来自不同器官的细胞在溶酶体活性方面是不相等的。在某些器官中,自噬和CMA可以增加,而在其他器官中则可以抑制。在结构上区分活性溶酶体和非活性溶酶体的因素、这种向性的起源以及在单个细胞和不同细胞类型中调节自噬通量的差异机制仍有待确定。CMA表现出组织特异性振荡,肝脏CMA活性在肾脏和心脏CMA活性最低的白天达到最高水平。这种活性的循环变化(以及分配给CMA的溶酶体的数量)影响了不同器官处理注定要被消除的蛋白质的能力。与巨噬的生物钟对营养的依赖性相反,CMA的昼夜节律活性不依赖于营养。这一发现与细胞中的其他修复和/或质量控制机制形成对比,为蛋白质组的昼夜节律重塑开辟了新的研究方向,并可能导致开发更有效的治疗应用化合物。它也可能有助于更好地定义调节CMA的药物的最佳给药窗口。

