1 背景知识介绍
印迹(Blotting)是将大分子(蛋白质,核酸等)从凝胶转移到固定膜的固体表面以检测已转移的分子的过程。最开做印迹的科学家叫Southern,主要研究的是DNA印迹,因此将Southern blot成为DNA印迹;随后相继发现了Northern blot (RNA 印迹)以及western blot (蛋白印迹)。Western blot是一种使用特定抗体来识别凝胶电泳分离的蛋白质的技术。首先应该知晓SDS-PAGE(Sodium Dodecyl Sulphate-Polyacrylamide Gel Electrophoresis)即十二烷基硫酸钠-聚丙烯酰胺凝胶电泳一般我们也将其简称为聚丙烯酰氨凝胶电泳。那么SDS和PAGE的作用是什么呢?
1.1 什么是SDS
SDS(Sodium Dodecyl Sulphate, 十二烷基硫酸钠),蛋白在在进行电泳的时候是线性结构,即蛋白的高级结构已经被破坏。一般来说,蛋白质是两性分子,在同一分子内同时具有正电荷和负电荷。因此,在电泳过程中,为了使蛋白质分子沿单一方向移动,蛋白质分子被赋予均匀的负电荷。带负电荷的是十二烷基硫酸钠(SDS),一种阴离子洗涤剂。天然蛋白质被SDS变性,因为它扰乱了蛋白质的非共价力。
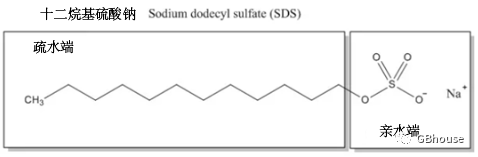
(图1 十二烷基硫酸钠(SDS)是一种阴离子洗涤剂,由亲水的头基和疏水的尾基组成。因此,当溶解时,它的分子在很宽的pH范围内形成净负电荷。)
由于SDS是一种清洁剂,蛋白质的三级结构被SDS破坏,使折叠的蛋白质变成线性分子。此外,SDS以统一的方式与线性蛋白结合。大约1.4 g SDS与1 g蛋白质结合。因此,SDS均匀地包裹在蛋白质的净负电荷上。这种负电荷掩盖了蛋白质中氨基酸的各种R基团上的固有电荷。此外,蛋白质的电荷与分子量成正比。SDS线性化后的蛋白质分子宽度为18埃,蛋白质的长度与分子量成正比。因此,在天然状态下,具有相同分子量的不同蛋白质在凝胶上的迁移速度不同。这使得分离聚丙烯酰胺凝胶中的蛋白质变得困难。将SDS添加到蛋白质中使蛋白质变性,并使其具有均匀分布的净负电荷。这允许蛋白质在电泳过程中向正极迁移。换句话说,SDS使蛋白质分子线性化,并掩盖了r基团上的各种类型的电荷。综上所述,SDS包被蛋白的电荷质量比是相同的,那么电泳时候就会根据蛋白的摩尔质量将不同蛋白分开。
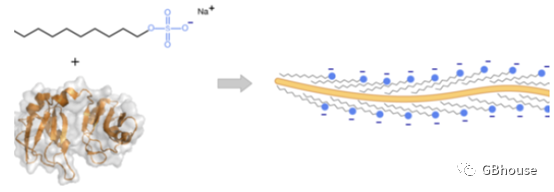
(图2 SDS是蛋白线性化原理.SDS取代蛋白的氨基酸上的R基团,然后使得蛋白线性化,并带上负电荷且电荷和质量比是相同的,电泳时候就只会根据摩尔质量将蛋白分开。)
1.2 什么是PAGE
PAGE(Polyacrylamide Gel Electrophoresis,聚丙烯酰氨凝胶电泳),如果将SDS变形蛋白质置于电场中,它们的速度不能被很好的控制并向正极移动,因为1.4g SDS结合1g蛋白,而蛋白均带上SDS的负电,此时不能很好的将蛋白根据大小分开,甚至是相同的速度转移到正极。 所以我们需要将蛋白质放入一个允许不同大小的蛋白质以不同速率移动的环境中。 那么聚丙烯酰胺,是一种很好的选择,因为它是丙烯酰胺单体的聚合物,当这种聚合物形成时,它会变成凝胶,我们将用电场将蛋白质在凝胶中运动,因此整个过程称为聚丙烯酰胺凝胶电泳 (PAGE)。 聚丙烯酰胺凝胶是由穿过纤维网状结构的迷宫般的隧道构成,会根据蛋白的大小很好的将蛋白分开。
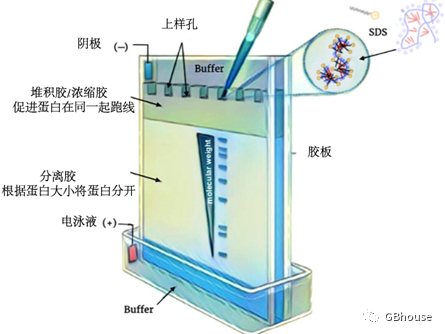
(图3 SDS-PAG分离蛋白示意图)
2 western blot 实践操作
2.1 蛋白样品准备
2.1.1 蛋白的提取
提取组织(需要提前研磨)和细胞,需要配制RIPA:PMSF=100:1(使用前最好看说明书,一般情况下是这个配方)。在此,我们以细胞6孔板为例进行举例说明。
一般6孔板,使用100μL的RIPA裂解液,使用1μPMSF。提前将RIPA和PMSF配置好,然后滴加至细胞中。然后用移液枪充分吹打细胞(如果有细胞刮板更好),于冰上裂解10分钟后。收集好裂解液,于12,000rpm 4℃离心10分钟(离心机提前预冷),收集65μL上清液(总体积大约80μL),这65μL即为目标细胞的蛋白溶液。
2.2 蛋白BCA定量分析
(a)蛋白稀释液配制:6μL蛋白溶液+24 μL RIPA裂解液(这样蛋白就稀释了5倍),混合均匀然后吸取5μL到新的24 μL RIPA,依次类推根据标准品的浓度进行稀释到对应的倍数,本次的BCA需要稀释6次;
(b)BSA试剂配制(pierce BCA protein assay):Reagent A :Reagent B =50:1,一般BSA使用体积是200μL,即检测浓度的时候是200μL BSA +25μL蛋白(这里不能算稀释,因为BSA已经将这一步的稀释做了处理)
(c)标准品孵育:将BSA 和 蛋白混合液在37℃孵育30分钟;
(d)样品定量:经过OD562 检测吸光度,进而确定蛋白浓度。
(图4 OD562 检测样品数据)
前期获得标曲:y = 0.0009x + 0.1486 (x检测蛋白浓度,y代表标曲中的浓度,即线性函数,不同浓度具有不同的Y值。那么蛋白浓度运算应该是:x= (y(即OD562)-0.1486) ÷0.0009。
(一般情况下蛋白上样量是10-40 μg)
2.1.2 SDS-PAG配制
首先根据蛋白的大小确定需要配制多大浓度分离胶,具体参考表1:
表1 不同浓度的SDS-PAGE分离胶的最佳分离范围
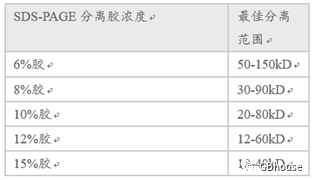
首先是配制分离胶,因为分离胶处于底层,需要提前配制,在此以10%的分离胶配制为例,具体配方如表2:
表2 10%分离胶配制不同体积的配制办法
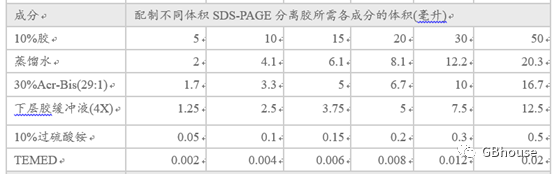
待分离胶凝固后配制浓缩胶,一般需要30min。接着是配制浓缩胶,因浓缩胶处于上层,所以要后配制,一般配制为5%的浓缩胶,具体配制办法见表3。
表3 浓缩胶的配制办法
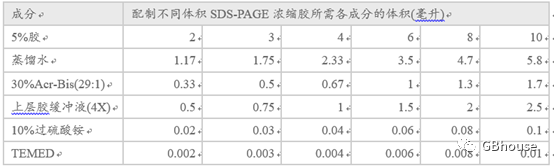
(当然现在市面上也有预制胶或者一次性成形的胶,就不用这么麻烦的去配制了)
2.1.3 running buffer 和trans buffer配制
在浓缩胶凝固的这段时间可以提前配制SDS-PAGE电泳液(running buffer)和转膜液具体配方见表4,5,其中表6是trans buffer的稀释配方。
表4 WB电泳液配制(10x配制2L,稀释时直接用蒸馏水即可)

表5 WB Trans buffer配制(10x-2L)
表6 trans buffer稀释

2.2 WB电泳
2.2.1 蛋白上样
通过对蛋白定量以后,知道每一个样的浓度。在上样时候保证一个泳道的蛋白总量为30μg(根据具体情况而定,一般不超过30μg)。同时需要保证每一个泳道上样体积保持一致,可用loadding buffer补足(可上30μL)。
2.2.2 蛋白电泳
浓缩胶使用100V电压进行电泳,一般是30 min(具体根据buffer是否到达浓缩胶与分离胶的交界处),进入分离胶以后可提高电压至150V进行电泳(一般1h),然后轻轻的将SDS-PAGE多余部分切割,浓缩胶与分离胶的交界处即可。
2.3 WB转膜
弄清楚转膜机器的正负极很重要,一般是这样子堆放各种样品:转膜板子:黑色一面(负极)→双层滤纸→SDS-PAGE胶→PVDF膜(提前用甲醇激活)→双层滤纸→红色一面(正极)→红色对应转膜槽的红色,黑色对应黑色。
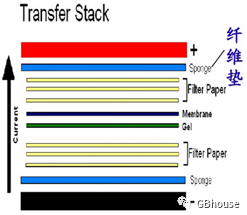
(图5 WB转膜时候各种样品堆放,其中胶上蛋白带负电,而PVDF膜应该在靠近正极的方向,这样转膜的时候,胶中负极的蛋白就能转到PVDF膜上)
2.4 转膜电泳
将提前与4℃预冷的转膜液(transfer buffer)添加至电泳槽中,可以在电泳槽的电泳液中添加一块冰袋。同时需要将电泳槽放置在冰冷的环境中进行电泳,一般是将电泳槽放在盆中,然后加入冰将其覆盖。设施电泳仪:400mA (2小时),要充分把握好转膜的时间,一般是选择两小时,时间过长会导致蛋白条带从PVDF膜上穿透除去。
2.5 PVDF膜封闭
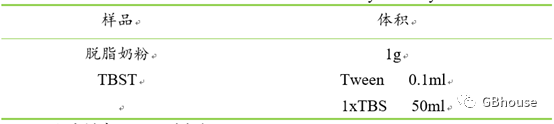
用封闭液(5% 脱脂奶粉吗,TBST稀释;目前市面上也有现场的封闭液)室温摇床上封闭PVDF膜1小时。关于封闭无非三个问题:选用何种封闭剂、封闭时间、封闭温度。对于封闭剂通常有BSA、脱脂奶粉、Casein、商业化的封闭剂,其中BSA、脱脂奶粉是用的最多的。原理上来讲,不同的封闭剂对抗体可能会存在差别,但个人实践来看奶粉的效果还是最好的。个人建议5%脱脂奶粉溶解于1×TBST中,室温封闭1h,或4℃过夜。如果后续杂交不好再考虑5%BSA溶解于1×TBST中,室温封闭2h,或4℃过夜。封闭时间过长或封闭剂的浓度过高都会降低检测灵敏度,因此信号杂交弱的时候,可考虑将封闭剂的使用浓度降低1~2倍。
表7 封闭液配制

2.6 一抗孵育PVDF膜
一抗稀释液是用TBS和BSA配制而成,一抗的使用浓度根据公司推荐的使用浓度,然后利用一抗稀释液进行稀释。一抗稀释以后一般是能够用较多次数的,因此在稀释的时候需要根据自己需要的体积进行稀释。得到一抗工作液以后,使用一抗工作液于4℃ 摇床最低速孵育PVDF膜过夜。一抗的孵育是Western Blot过程中最为关键的部分,大多数优化条件都在这个步骤中调整。影响一抗结合抗原的因素比较多,大体包括:封闭剂种类、孵育温度和时间、一抗使用浓度、一抗质量。
表8 一抗稀释液配制

2.7 二抗孵育PVDF膜
首先将一抗孵育的PVDF膜用TBST洗涤3次,每次5分钟。然后使用二抗工作液室温孵育PVDF膜1小时。二抗工作液是一次性的,因此为了节省抗体,可以需要多少配制多少,而且比例是同一的1:8000(具体根据实际公式的推荐)。例如取20ml TBST,加0.2g脱脂奶粉,在家0.25μL对应二抗,即配制成了1:8000的二抗工作液。
表9 二抗稀释液的配制
2.8 显影液孵育PVDF膜与拍照
一般一张膜使用显影液A和B液各1ml混匀后,将PVDF膜放入暗盒中盛有显影液孵育5分钟,在孵育的过程中需要不停的摇晃暗盒,不要太剧烈。然后于仪器中拍照。

