线粒体自噬受体、受损线粒体或线粒体自噬体囊泡的频繁积累表明,该过程在溶酶体降解线粒体之前就已停止。这与多种人类疾病中观察到的溶酶体活性突变和功能缺陷相一致。还有一个可能的机制是整体细胞能量不足,这可能影响了线粒体自噬成分的有效合成与折叠,以及自噬体和溶酶体的正确组装和功能。因此,功能失调的线粒体自噬与细胞稳态的破坏有关,并与健康状况恶化、衰老和疾病的其它标志如炎症和氧化应激存在关联(图2c)。
虽然生理性的信号分子有其作用,但随着年龄增长,线粒体自噬的改变和抗氧化剂缓冲的减少导致高水平ROS的产生,可能对大分子和细胞器成分造成氧化损伤,如脂质过氧化和蛋白质毒性。这些压力和氧化损伤与衰老和相关疾病的发生发展有关。
受损的线粒体还会在细胞质或细胞外释放一组被称为线粒体损伤相关分子(mtDAMP)的分子,包括氧化mtDNA、线粒体RNA(mtRNA)和心磷脂。由于其细菌血统、缺乏组蛋白和低甲基化CpG基序,胞浆mtDNA被先天免疫的模式识别受体感知为“非自身”。它可以激活炎症通路,例如NLR家族、NLRP3炎症小体、cGAS-STING通路、炎症反应的检查点DNA转录和TLR系统。
虽然NLRP3炎性体激活最终导致Caspase-1激活并通过IL-1和IL-18产生促炎信号传导,但TLR和cGAS-STING通路的激活会诱导细胞衰老和I型干扰素信号传导。mtRNA还可被mtRNA感应MAVS-RIG1复合物识别为“非自身”,并触发IFN-γ反应。最后,心磷脂从线粒体内膜突出,导致细胞色素c介导的细胞凋亡,但当释放并最终在细胞质中氧化时也可以充当mtDAMP,与TLR4结合并通过NF-κB起作用。
临床前研究证实了线粒体自噬与mtDAMP介导的炎症之间的因果关系。基于细胞的研究显示,增加线粒体自噬可以减少mtDNA氧化和释放,并减弱TLR9促炎症信号传导。在小鼠模型中,PINK1和Parkin活性可以减轻STING诱导的炎症,线粒体自噬激活可以提高小胶质细胞的吞噬效率,并通过抑制NLRP3信号传导来减轻神经炎症。
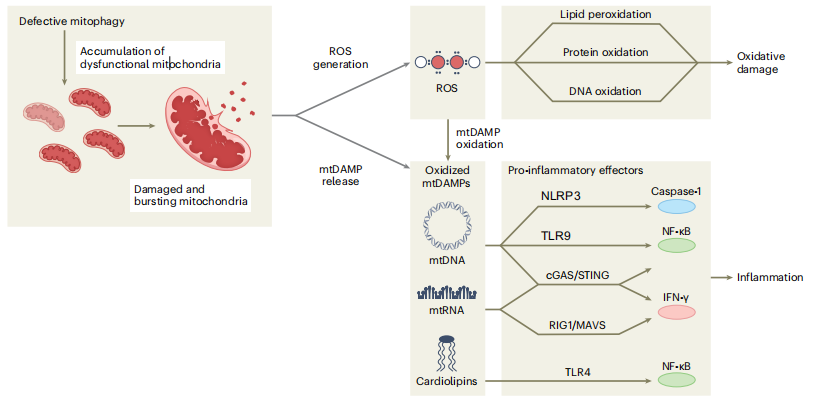
图3:线粒体自噬功能障碍与无菌炎症反应有关
线粒体自噬的缺陷会导致受损和产生过氧化物的线粒体积累。这些线粒体有可能发生破裂,将其内容物释放到细胞质或细胞外环境中。当低质量的线粒体释放过多的过氧化物时,会引发脂质过氧化和蛋白质、核酸氧化等氧化损伤,进一步对细胞造成损害。此外,过氧化物的过量产生还会导致线粒体成分的氧化,这些成分被称为mtDAMP。mtDAMP包括mtDNA、mtRNA和心磷脂。
这些成分被不同的先天免疫受体所识别,可以激活下游信号通路,从而引发先天免疫触发的炎症反应。具体来说,mtDNA可以激活NLRP3炎症小体、TLR9和DNA感应cGAS-STING通路。NLRP3炎性体的激活最终会导致Caspase-1的激活和促炎信号的传导。而TLR9和cGAS-STING通路的激活会导致NF-κB驱动的细胞因子产生。cGAS-STING还可以引发INFγ反应。另一方面,mtRNA可以被mtRNA感应MAVS-RIG1复合物识别为“非自身”,并触发INFγ反应。最后,从线粒体内膜突出的心磷脂可以与TLR4结合,并通过NF-κB激活促炎信号。
最近的研究表明,线粒体自噬和mtDAMP诱导的炎症之间存在紧密的联系。线粒体自噬的损伤和mtDNA的泄漏已被证实可以激活患有肝损伤的老年巨噬细胞中的STING信号传导。此外,在间质性肺疾病患者中,发现PINK1的低表达和游离mtDNA的高水平,这包括特发性肺纤维化、过敏性肺炎和自身免疫相关的间质性肺疾病。另外,无细胞mtDNA和相关的无菌炎症被认为是导致与年龄相关的肌肉萎缩的重要因素。
此外,mtDAMP的释放也会引发促炎信号,从而加重细胞损伤。相反,健康的线粒体自噬机制则能够有效地循环利用线粒体,预防细胞损伤信号并保持最佳的呼吸效率。这是因为健康的线粒体自噬机制能够保留更多功能健全的线粒体,并通过协调激活线粒体生物发生来增加线粒体含量(图2c)。

