生物屋 2024-06-09 20:14 上海
[概述]
细胞培养(Cell culture)是在体外模拟体内温度、酸碱度、营养条件等环境,使之生存、生长、繁殖并维持主要结构和功能的一种方法,细胞培养也叫细胞克隆技术。
细胞培养是细胞和分子生物学中使用的主要工具之一,为细胞正常生理学和生物化学研究(例如代谢研究、衰老)、药物和毒性化合物对细胞的作用以及致突变性和致癌性研究提供了出色的模型系统。细胞培养还可用于药物筛选和开发,以及生物化合物(例如疫苗、治疗性蛋白质)的大规模生产。
对于细胞培养,大多初学者常常在进行实验时遇到困难和挑战,不仅要处理细胞贴壁不牢、细胞突然被污染、细胞死亡等问题,而且细胞培养的步骤繁琐、失败率较高,每一个操作都需要小心谨慎。针对这些情况,接下来将详细介绍细胞复苏、传代、冻存等一系列具体的操作步骤和实验要点,希望每位在细胞培养方面能够轻车熟路。
[细胞类型]
根据细胞的来源不同可分为三种类型:
(1) 原代细胞(Primary cell):直接从体内取出的细胞、器官或者组织分离出的第一代细胞。更接近于细胞的在体状态和特性,但获取及培养均较难。一般认为,将第1~10代培养细胞统称为原代培养细胞。在人工条件下,原代细胞被培养和传代,用于研究细胞的生命周期、细胞癌变、细胞工程等问题。
(2) 细胞系(Cell line):是由原代培养物经首次传代成功后,在体外培养条件下不断分裂和繁殖而形成的细胞群。
特征:1)细胞系通常来自于原代细胞培养物、单个原始组织或细胞的特定个体。该单个细胞通过分裂和传代培养,不断产生相同类型的细胞,形成一个可持续的细胞系。2)细胞系可理解为可连续传代的细胞,其中能够连续传代的细胞叫做连续细胞系或无限细胞系(可培养50代以上),不能连续培养的称为有限细胞系。3)细胞系常用于探究细胞的生物学特性、疾病机制以及药物开发等,在基础生物学研究、药物筛选等领域广泛应用。
(3) 细胞株(Cell strain):是通过选择法、克隆形成法或其他方法从原代培养物或细胞系中获得具有特殊性质或标志物的培养物。大部分情况下为细胞系的某一特定分支或亚群,细胞株可培养40~50代。
特征:1)细胞株是原代细胞或细胞系的一个分支,通过特定的处理或分选过程从原始细胞或细胞系中分离而来。2)细胞株可能具有特定的生物学特性或标志,且该特征或标志必须在整个培养期间始终存在。3)细胞株常用于特定的研究任务或生产工艺中,例如,某些细胞株可能更适合生产蛋白质、疫苗或其他生物制品。
根据细胞的生长方式可分为三种类型:
(1)贴壁细胞:指在培养基表面附着生长的细胞。这类细胞在培养皿内沿着培养基表面贴壁生长,正常细胞形态较好,轮廓清晰,边缘透亮,细胞增殖状况良好。当贴壁细胞生长到密度达到90%时,需要进行传代以维持其正常生长状态。
活体体内的细胞当离体置于体外培养时,大多数以贴壁方式生长,主要包括一些正常细胞和肿瘤细胞,比如成纤维细胞,骨骼组织(骨及软骨),心肌与平滑肌、肝、肺、肾、乳腺皮肤神经胶质细胞,内分泌细胞,黑色素细胞以及各种肿瘤细胞等。而少数细胞在体外培养时悬浮生长,包括一些取自血、脾或骨髓的培养细胞,尤其是血液白细胞以及淋巴细胞等。
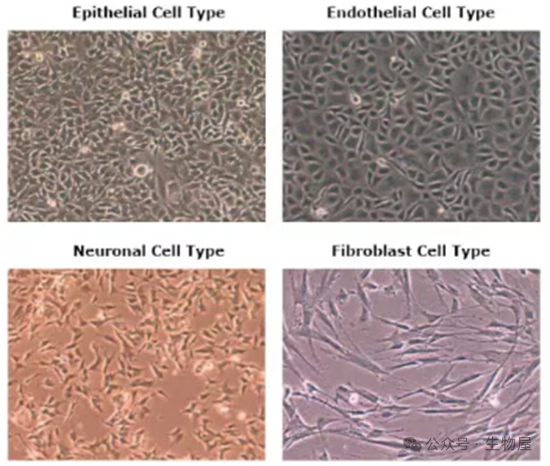
贴壁细胞系可分为
1) 内皮细胞系,例如 BAE-1;
2) 上皮细胞系,例如 HeLa;
3) 神经细胞系,例如 SH-SY5Y;
4) 成纤维细胞,例如 MRC-5。
(2)悬浮细胞:指在培养基中悬浮生长的细胞,不依附于培养皿表面。这类细胞在培养基中均匀分散生长,通常需要使用适当的搅拌或旋转设备来保持细胞的悬浮状态。悬浮细胞适合用于大规模培养和生产。
(3)半贴壁半悬浮细胞:指在培养基中部分附着生长,部分悬浮生长的细胞。这类细胞同时具备贴壁细胞和悬浮细胞的特点,通常在培养基中部分附着生长,部分悬浮于培养基上。对于此类细胞的培养需要综合考虑贴壁和悬浮培养的条件来进行。

根据细胞的形状可分为三种基本形态:
(1) 成纤维细胞样(Fibroblast-like)是双极或多极细胞,呈细长的形状,并附着在基质上生长。
(2) 上皮细胞样(Epithelial-like)呈多边形,尺寸更规则,并附着在基质上分呈散在斑片状生长。
(3) 类淋巴母细胞样(Lymphoblastoid-like)呈球形,通常悬浮而不附着于表面生长。
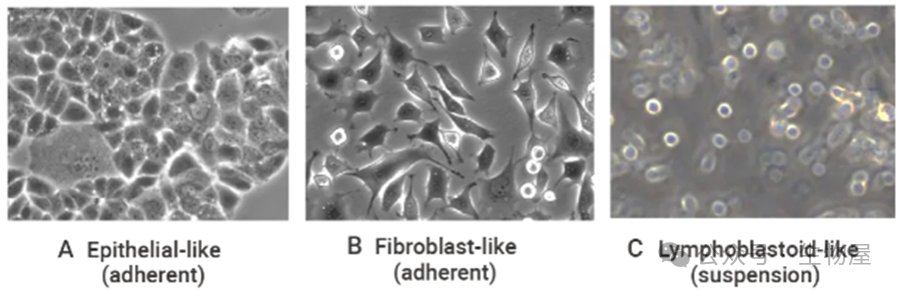
图 1. 培养细胞的一般特征和形状。
(A) 上皮样 (贴壁);(B)成纤维细胞样 (贴壁);(C)淋巴母细胞样 (悬浮液)。
[体外培养细胞的条件]
(1)营养需求
·氨基酸----12种必须氨基酸(缬氨酸、亮氨酸、异亮氨酸、苏氨酸、赖氨酸、色氨酸、苯丙氨酸、蛋氨酸、组氨酸、酪氨酸、精氨酸、半胱氨酸);10种非必须氨基酸;此外还需要谷氨酰胺,它在细胞代谢过程中有重要作用,所含的氮是核酸中嘌呤和嘧啶合成的来源,同样也是合成三、二、一磷酸酰苷所需要的基本物质。
·碳水化合物----糖类--葡萄糖;半乳糖;细胞对葡萄糖的吸收能力最高,半乳糖最低。
·无机盐----钠、钾、镁、磷、钙等;
·维生素----生物素、叶酸、核黄素、维生素C、维生素B12、吡哆醇等;
·蛋白质与肽----白蛋白、抑肽酶、胎球蛋白、纤粘连蛋白、转铁蛋白、生长因子;
·脂肪酸和脂类物质----亚油酸、油酸、胆固醇等;
·微量元素----铁、锌、硒、铜、锰、钼、钒等。
(2)温度
最常用的温度是37°,但需要注意不同生物来源的组织细胞,最适宜的培养温度是不同的,且细胞耐低温,不耐高温。在生理温度范围内,温度与细胞生长率呈正相关。
(3)渗透压
渗透压的大小主要由培养基中各种盐成分的浓度决定。细胞必须生活在与自身原生质体等渗的环境中,若生存环境渗透压高于自身,培养的细胞则有可能会面对脱水而亡,若生存环境渗透压低于自身,培养的细胞则有可能面对吸水涨破而亡,但大多数培养细胞对渗透压有一定耐受性。人血浆渗透压290mOsm/kg, 可视为培养人体细胞的理想渗透压。鼠细胞渗透压在320mOsm/kg左右。对于培养大多数哺乳动物细胞,控制培养基的渗透压在260-320mOsm/kg的范围为宜。
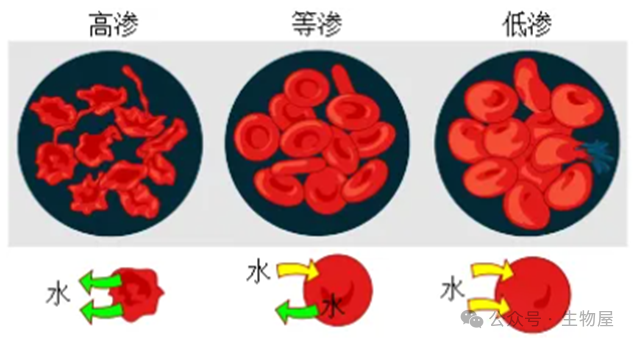
左侧模拟:红细胞处在高于自身胞液浓度的某溶液中,细胞脱水皱缩直至死亡;
右侧模拟:红细胞处在低于自身胞液浓度的某溶液中,细胞吸水涨破而亡;
中间模拟:红细胞处在等于自身胞液浓度的某溶液中,细胞形态正常。
(4)气相
体外细胞培养的气相环境常由5% CO2与95%空气构成。其中O2参与细胞的能量代谢过程。CO2用于维持培养液的酸碱度。
(5) pH
适宜大多数细胞生长的培养基pH在7.0-7.4之间,pH7.4的环境适合大多数的哺乳动物细胞系。酚红在培养基中被用来作为pH值的指示剂,用以持续监测培养液的酸碱度,在低pH值时酚红使培养液呈黄色,而较高的pH值时使培养液呈紫色,pH值7.2-7.4时为红色,最适合细胞培养。
(6)无毒无污染
无毒和无菌是体外培养细胞的前提条件。在活体的细胞的解毒系统和免疫系统,可抵抗微生物或其他有害物质的入侵,但细胞在体外培养中,缺乏机体免疫系统的保护从而丧失对微生物的防御能力和对有害物质的解毒能力。因此保证细胞的生长环境的无毒无污染是细胞培养成功的首要条件。在细胞培养过程一定要注意防止有毒化学物质污染、微生物污染、不同细胞间交叉污染。
[细胞培养基类型]
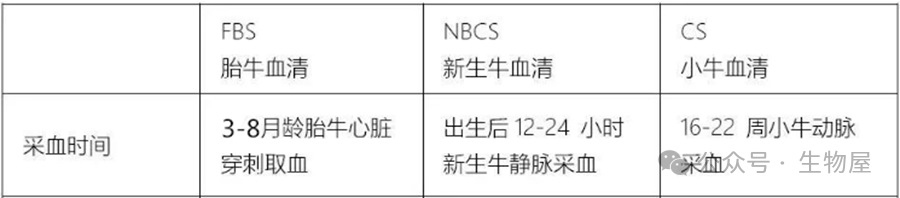
细胞培养基是用于支持细胞在体外生长和繁殖的营养溶液。根据不同的需求和应用,细胞培养基分为多种类型,包括合成培养基、天然培养基、无血清培养基,平衡盐溶液等。
(1)天然培养基:
天然细胞培养基是最早的细胞培养基,直接取自于动物组织提取液或体液,如血浆凝块、血清、淋巴液、胚胎浸出液等,其营养价值高,但成分复杂,差异大、不稳定,来源也受到限制。最常用的天然培养基是血清,尤其是小牛血清,因它含有多种细胞生长因子和促贴附因子。但由于安全性问题,现代细胞培养越来越倾向于使用无血清或减少血清依赖的培养基。
血清主要作用:
1) 提供氨基酸、维生素、无机物、脂类物质、核酸衍生物等细胞生长必须的营养物质。
2) 提供激素(胰岛素、肾上腺皮质激素、类固醇激素等),和各种生长因子(成纤维细胞生长因子、表皮生长因子、血小板生长因子等)。
3) 提供结合蛋白,作用是携带重要的低分子量物质,如白蛋白携带维生素、脂肪、以及激素等,转铁蛋白携带铁。结合蛋白在细胞代谢过程中起重要作用。
4) 提供促接触和伸展因子,使细胞贴壁免受机械损伤,对培养中的细胞起到保护作用。
(2)合成培养基:
合成细胞培养基是用化学成分明确的试剂配制的培养基,组分稳定,主要包括糖类、必需氨基酸、维生素、无机盐类等。由于天然培养基的一些营养成分不能被合成细胞培养基完全代替,因此一般需在合成细胞培养基中添加5%~10%的小牛血清。
合成培养基组成及作用:
1)氨基酸:不同的细胞对氨基酸的需求各异,但几种必需氨基酸细胞自身不能合成,必须依靠培养液提供,如组氨酸、异亮氨酸、赖氨酸、蛋氨酸等。此外,谷氨酰胺对细胞的培养特别重要,能促进各种氨基酸进入细胞膜,所含的氮是核酸中嘌呤和嘧啶的来源,还是合成—磷酸腺苷、二磷酸腺甘和三磷酸腺苷的原料,谷氨酰胺缺乏可导致细胞生长不良甚至死亡。
2)维生素:维持细胞生长的生物活性物质,对细胞代谢有重要作用,在细胞中大多形成酶的辅基或辅酶,没有维生素,酶就没有活性,代谢活动将无法进行。维生素分为水溶和脂溶两大类,的培养液中直接采用ATP和辅酶A。
3)葡萄糖:大部分培养基都以葡萄糖作为能量来源之一。
4)无机盐:维持培养基渗透压平衡,参与细胞的代谢活动。主要有Na+、K+、Ca2+、Mg2+等。Na+是细胞外液中最主要的阳离子,对维持渗透压的恒定有决定性的作用。K+主要分布在细胞内液,细胞内K+对于激活某些酶是必需的,并在调节细胞内环境的酸碱平衡上也有极重要意义。Ca2+在细胞外液中的作用是将组织内部细胞之间相互粘着,在细胞内参与许多重要的细胞生理活动,如传导、参与肌肉细胞收缩等。在悬浮培养时,为了减少细胞的聚集和附着,要减少Ca2+的浓度。Mg2+是构成细胞间质的重要成分,对于细胞间相互稳定结合有很重要的意义。磷的化合物对细胞物质代谢和生理功能调控有重要作用。
5)其他成分:肽、核苷、嘌呤等。可帮助细胞的克隆化培养及维持某些特殊细胞系的生长。
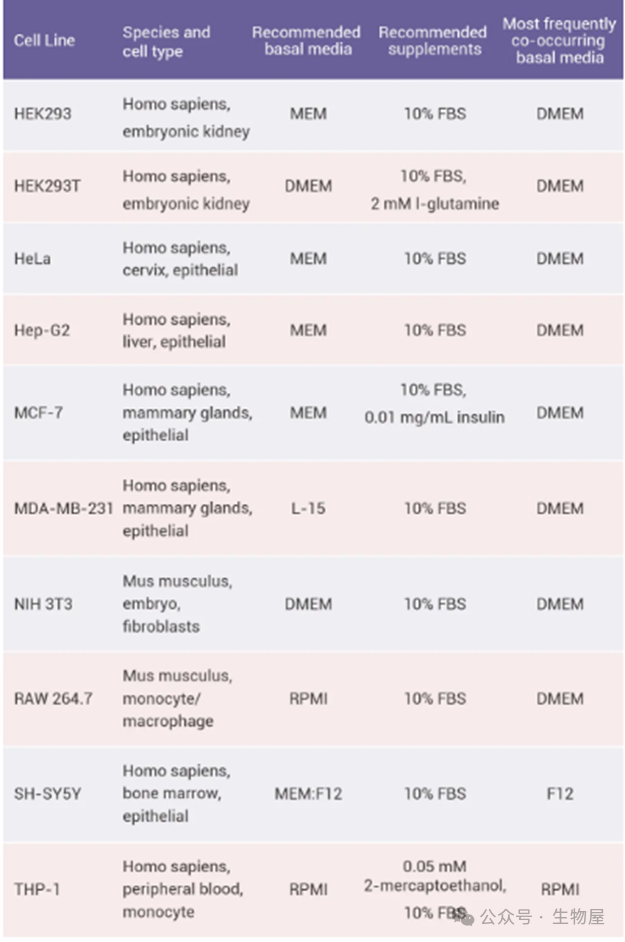
常用基础细胞培养基
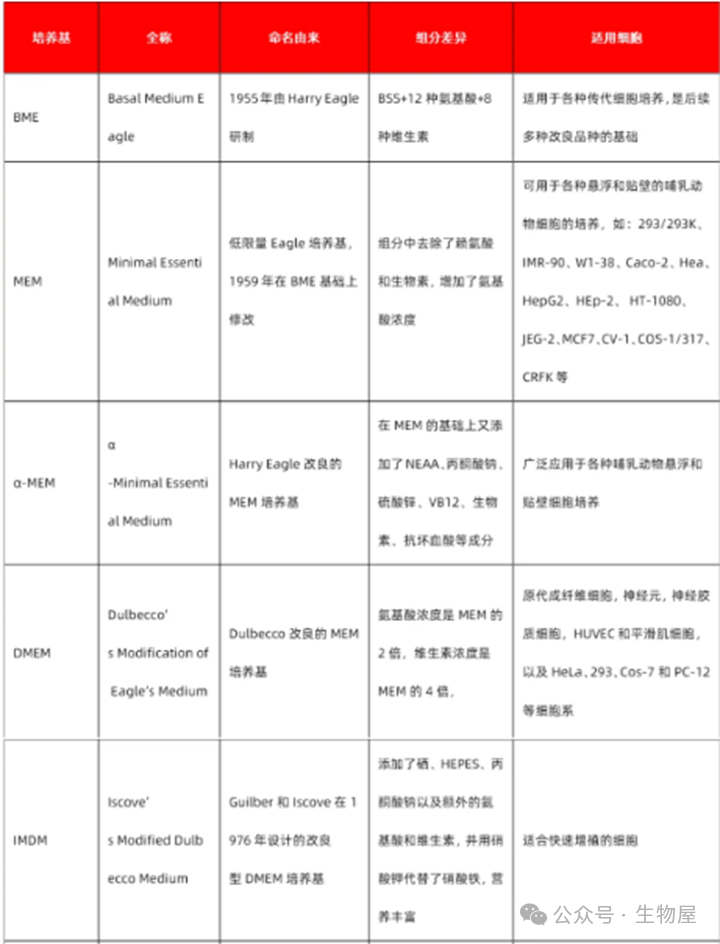
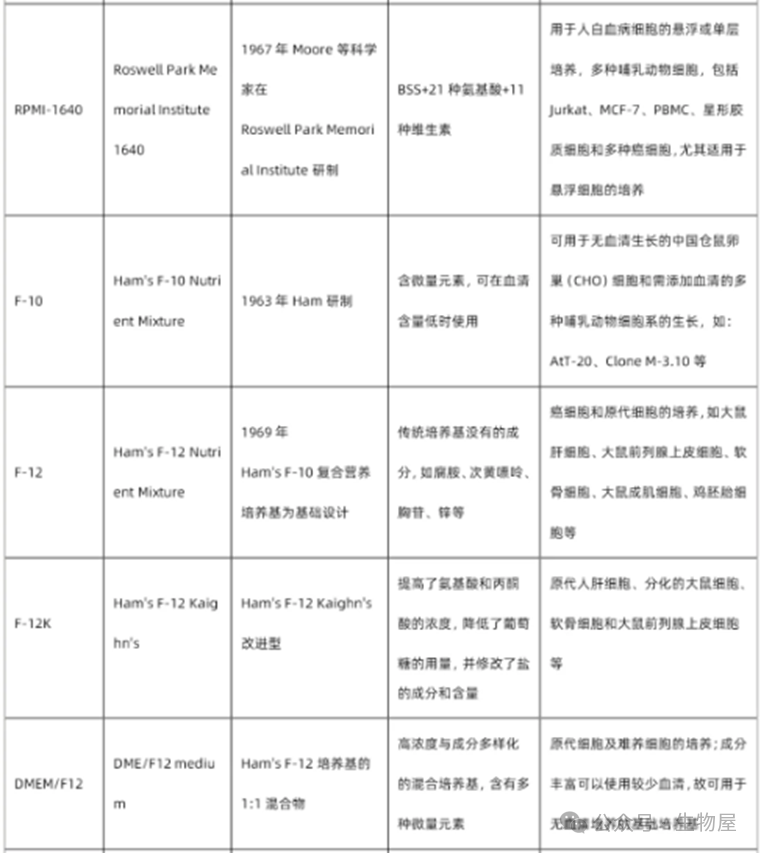
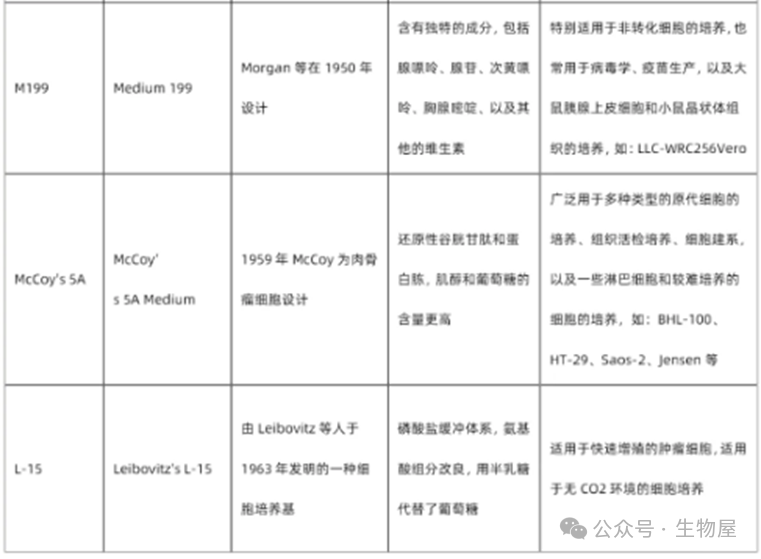
常见细胞的培养体系
(3) 无血清培养基:
指不含任何动物来源的血清成分,以减少潜在的传染病风险和提高实验的可重复性。无血清培养基通常需要添加特定的化学添加剂来模拟血清中的作用。目前已有多种无血清培养基上市,如杂交瘤细胞无血清培养基、CHO细胞无血清培养基、Vero细胞无血清培养基等。无血清培养基通常添加生长附加成分,如激素与生长因子、低分子营养成分和转铁蛋白等促细胞生长的附加成分,一般包括胰岛素、孕酮、硒酸钠、腐胺、转铁蛋白等。
(4) 平衡盐溶液:
通常包括Na、Na3PO4、钾 K、 Ca、Mg和Cl。K和Na调节渗透性和张力,而Mg和Ca保持细胞膜和内部结构的完整性。通过磷酸盐和碳酸氢盐,平衡盐溶液还能控制氢离子浓度,有些还包括葡萄糖等碳水化合物,可以为细胞提供能量。常用的平衡盐溶液有DPBS、HBSS、EBSS。
1)DPBS
即Dulbecco's Phosphate-Buffered Saline,杜氏磷酸缓冲盐溶液,是生物学、生物化学研究中使用较广泛的一种平衡盐溶液,DPBS和PBS成分类似,区别在于DPBS中Na2HPO4与KH2PO4的添加量略小于PBS。DPBS主要用于胚胎学方面的研究,可作为胚胎、组织、细胞的漂洗液、冻存液和培养液。可根据需要在DPBS中加入葡萄糖、丙酮酸钠等,以维持培养物的基本营养。
2)HBSS
即Hank's Balanced Salt Solution,Hank's平衡盐溶液,是细胞分离或培养中常用的磷酸盐缓冲液之一,主要成分为NaCl,KCl,KH2PO4,Na2HPO4,NaHCO4和葡萄糖,具有维持渗透压、保持pH稳定、提供简单营养等作用,可用于体外实验中组织块、器官或细胞的漂洗、细胞或组织的运输、细胞培养用试剂的配制以及作为细胞计数的稀释液,也可用于细胞摄取、转运等实验。
3)EBSS
即Earle's Balanced Salt Solution,Earle's平衡盐溶液,是细胞分离或培养中常用的磷酸盐缓冲液之一。EBSS专为CO2环境中的细胞短期维持而设计,主要成分为葡萄糖,NaHCO3,NaCl,KCl和Na2HPO4,具有维持渗透压、保持pH稳定、提供简单营养等作用,可用于体外实验中组织块、器官或细胞的漂洗、细胞或组织的运输、细胞培养用试剂的配制以及作为细胞计数的稀释液,也可用于诱导细胞自噬等。
[培养原则]
(1)无菌原则:
1)操作台环境无菌:在实验操作前,必须对操作台进行紫外线消毒至少30分钟,然后用75%酒精擦拭,确保操作台表面无菌。
2)实验材料无菌:对实验所需材料进行无菌处理,包括紫外线照射、酒精擦拭、使用酒精灯进行消毒,以及使用封口膜保持材料的无菌状态。
3)实验时手部无菌:进行实验操作前,必须对双手进行消毒,确保双手无菌状态,避免细菌感染。
4)实验操作无菌:在实验操作过程中,必须保持操作环境和操作方式无菌,避免细胞培养过程中受到外界细菌的污染。
(2)减少细胞环境扰动原则:
1)保持培养箱内温度恒定:在进行细胞培养操作前,要确保培养箱内温度稳定,同时对培养基进行预热,以保持细胞在适宜的环境中生长。
2)转移细胞时轻拿轻放:在进行细胞转移操作时,要轻柔地操作,避免造成细胞的震动和损伤。
3)控制细胞在培养箱外的时间:尽量缩短细胞在培养箱外的时间,以维持CO2浓度的稳定,确保细胞在最适宜的环境中生长。
4)枪头吹打要轻柔:在使用枪头吹打时要注意轻柔操作,避免对细胞造成破坏,保证细胞的健康生长。
[具体步骤]
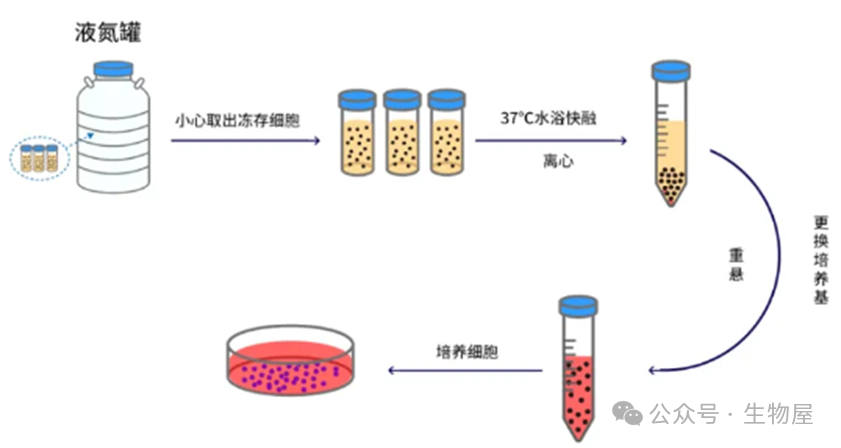
一、细胞复苏
(1)将工作所需的器具,如10ml移液管、移液枪、1ml枪头、50ml离心管、T25培养瓶、酒精灯、废液缸等摆放到超净工作台上,经过紫外灯照射30分钟和通风30分钟后开始操作;
(2)预先加热培养基;
(3)用75%酒精对器具进行消毒,放入超净工作台内;
(4)从液氮罐中取出冻存细胞;
(5)将冻存细胞放入37℃水浴锅中,利用快速晃动使其迅速融化;
(6)用75%酒精对器具进行消毒,放入超净工作台内;
(7)吸取9ml培养基到50ml离心管中;
(8)用1ml枪头吸取解冻的细胞悬液注入离心管中;
(9)进行1000r/min的离心,持续5分钟;
(10)用75%酒精对器具进行消毒,放入超净工作台内;
(11)吸除上清液;
(12)吸取1ml培养基再次悬浮细胞,将细胞悬液转移至培养瓶内,添加适量培养基,轻轻晃动培养瓶使细胞均匀分布,并做标记;
(13)在显微镜下观察恢复的细胞密度和状态;
(14)将细胞放回培养箱中静置培养。
Tips:
(1)取出液氮罐中的细胞时,务必加强个人防护,以免受到冻伤;
(2)取出冻存细胞后,如未立即放入水浴锅中融化,需在干冰上暂时保存;
(3)细胞水浴解冻时间控制在1分钟内,确保慢速融化;
(4)已融化的细胞避免较长时间常温保存,需尽快进行离心去除DMSO;
(5)新恢复的细胞粘附尚不牢固,应避免在24小时内频繁观察和更换培养基;
(6)将培养瓶放入培养箱内,轻轻旋松瓶盖以保证气体充分交换(如果使用透气性瓶盖,则无需旋松瓶盖)。
二、细胞传代
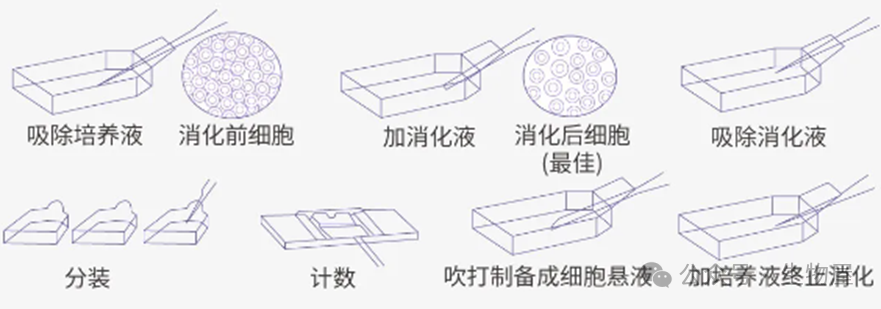
(一)贴壁细胞传代的具体步骤:
(1)在显微镜下观察细胞密度,确保细胞汇合度大于80%,表示细胞已经长得比较密集,可以进行传代了。
(2)在超净工作台上准备好所需的器具,例如移液管、移液枪、T25培养瓶、1ml枪头、PBS溶液等,并经过紫外灯照射和通风消毒。
(3)提前将培养基放在37℃的水浴锅中预热。
(4)使用75%酒精对移液器具、培养瓶等进行消毒。
(5)在培养箱内旋紧培养瓶瓶盖后,取出需要传代的细胞,并在超净工作台上消毒处置。
(6)吸去培养瓶中的上清液。
(7)用5ml的PBS液轻轻润洗细胞,然后吸去PBS。
(8)向培养瓶中加入1ml胰酶,轻轻摇晃使胰酶覆盖细胞层,放入培养箱孵育。
(9)在显微镜下观察细胞解离情况,当细胞明显变圆、细胞间隙增大并呈现流沙状时,停止消化。
(10)加入4ml培养基终止消化,轻轻吹打细胞层表面,使细胞分散成单个细胞。
(11)将细胞悬液收集到50ml离心管中,进行1000-1200r/min的离心,3-5min去除胰酶。
(12)在超净工作台上消毒离心管,吸去上清液,用新鲜培养基重新悬浮细胞。
(13)按照传代比例将细胞悬液分装到新的培养瓶中,补充适量培养基后,摇晃使细胞均匀分布,并标记好。
(14)观察细胞密度和状态,然后将细胞放回培养箱中,旋松瓶盖以确保气体交换畅通。
Tips:
(1)在润洗细胞时,要轻柔地加入PBS,避免对细胞层造成冲击。
(2)不同细胞的消化时间会有所不同,根据细胞的特性和胰酶的敏感度调整消化时间,可每隔30秒观察一次细胞状态。
(3)胰蛋白酶传代培养细胞的最佳方法:在添加胰蛋白酶之前,用不含Ca2+ 和 Mg2+ 的生理盐水/PBS清洗,以去除这些离子 (溶液中的 Ca2+、Mg2+和血清会降低胰酶活力);用最低浓度和体积的胰蛋白酶从培养瓶表面去除细胞;如果可能的话,在室温或更低的温度下使用胰蛋白酶溶液,以减少酶的内吞作用;尽可能短的时间使用胰蛋白酶处理细胞,避免消化过度影响细胞;用胰蛋白酶抑制剂如含血清或血清的完全培养基中和终止胰蛋白酶活性,然后用离心除去胰蛋白酶;细胞脱落后立即离心除去培养瓶表面的胰蛋白酶。
(二)悬浮细胞传代
(1)在显微镜下观察细胞的状态及密度,确保细胞长得比较密集,可以进行传代。
(2)将移液管、移液枪、T25培养瓶、1ml枪头、PBS溶液等放入超净工作台,经过紫外灯灭菌30分钟后通风30分钟。
传代方法一:
(1)从培养箱中取出培养瓶,在超净工作台上轻轻晃动使细胞分布均匀。
(2)使用移液管吸取200ul的细胞悬液进行计数,根据计数结果确定传代的比例。
(3)将细胞分装到新的培养瓶中,加入适量的新鲜培养基,并做好标记。
(4)将培养瓶放回培养箱中,旋松瓶盖以确保充分的气体交换。
传代方法二:
(1)将细胞悬液转移至离心管中,以800r/min的速度离心3-5分钟。
(2)吸取上清液。
(3)用1ml预热的培养基重新悬浮细胞沉淀,根据需要将细胞稀释,然后分装到培养瓶中,加入10ml的培养基,并做好标记。
(4)将培养瓶放回培养箱中,旋松瓶盖以确保充分的气体交换。
Tips:
悬浮细胞需要用未经TC处理的细胞瓶或培养皿培养,如悬浮细胞无碎片,建议按照方法一进行传代。
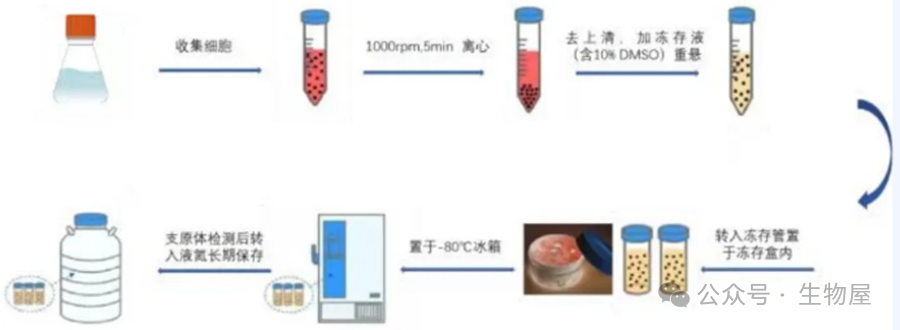
三、细胞冻存
(1)将细胞悬液倒入50毫升的离心管中,以1000-1200转/分钟的速度离心3-5分钟;
(2)丢弃上清液;
(3)用预冷的(2-8℃)低温冻存液重新悬浮细胞沉淀(建议细胞密度为1×106~1×107个/ml);
(4)将细胞悬液分装到冻存管中,并标记细胞种类、冻存时间及操作人员。在分装过程中要轻轻混合细胞,以保持均匀的细胞悬浮状态;
(5)将冻存管转移到程序降温盒中,并置于-80℃冰箱中冻存,4小时后或过夜后转移到液氮中(若使用无血清冻存液,则直接放入-80℃冰箱,24小时后转移到液氮长期保存)。
Tips:
(1)选择处于对数生长期的细胞进行冻存,此时细胞状态较佳;
(2)冻存的细胞不宜长期存储在-80℃环境中,应尽快转移至液氮罐中;
(3)细胞冻存后,应拿出一管进行复苏,并检测细胞的存活率。一般情况下,细胞可以在液氮中长期保存,为了稳妥起见,可在细胞冻存半年后进行复苏培养,观察细胞生长情况后再继续冻存;
(4)不同的冻存液冻存方式会有所不同,具体细节请查看对应的说明书。
·若选用通用细胞冻存液或自配冻存液,细胞分装完后将冻存管放入梯度降温盒直接放置于-80℃冰箱中。
·若不是用程序降温盒,则按照下列顺序依次降温:室温→4℃20min→-20℃30min→-80℃过夜,注意转移过程中要保冷,避免产生温差或冻存管融化。
·若选用非程序细胞冻存液,可用非程序性冻存液重悬细胞后,直接将冻存管分散放入-80℃冰箱中。过夜后即可将细胞转移入液氮长期保存。

[细胞实验图例]

[体外培养细胞生长过程]
(1) 原代培养期
原代培养期也称初代培养期,指从体内取出组织、器官或细胞开始培养到第一次传代前的这一阶段。一般持续1-3周。
(2)传代培养期
当原代培养的细胞达到一定程度,将原代培养物分别接种到两个或两个以上的器皿内进行培养,培养过程进入了传代培养期。传代培养期是整个细胞培养过程的主要时期,持续时间长。在传代培养期内,需要进行多次的传代。根据每一次传代培养的细胞生长变化的过程,习惯上把每一代细胞的生长过程分为潜伏期、指数生长期、平台期、衰退期四个阶段。
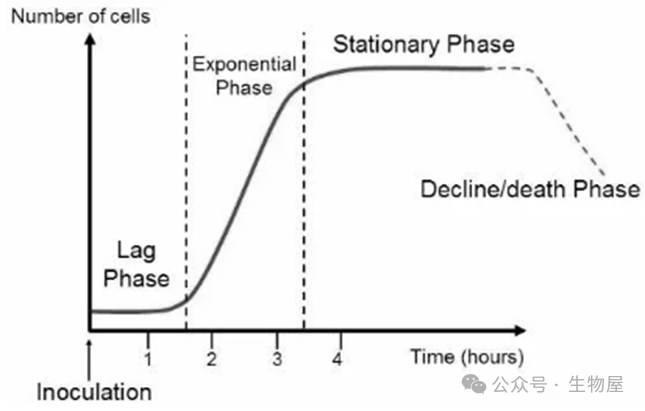
潜伏期:细胞适应培养条件的阶段,细胞在此阶段不分裂。细胞通常在起始培养后的24小时内附着,该阶段的总时长取决于培养之初使用细胞的生长阶段和接种密度。
指数生长期:细胞在此阶段积极分裂,是评估群体生长和通用数据收集的最佳时间。是传代细胞(亚培养)的最佳时机。
平台期:随着细胞达到100%融合,细胞在此阶段生长放缓,不足1/10的细胞处于活跃细胞周期。细胞在此阶段最容易受伤,因此需要小心观察以确保细胞在此阶段之前或之初进行传代。
衰退期:细胞周期的自然组成部分。在此阶段,随着细胞死亡占据主导地位,活细胞群体数量减少。
[注意事项]
1. 从液氮中取细胞时要佩戴护目镜和手套,谨防冻伤及冻存管爆炸!
2. 通常建议在可见冰融化但样品仍然冰冷(~0℃)时立即停止解冻,常见的做法是在只剩下一小片冰时从水浴锅中取出样品。升温至室温或更高温度会增加冷冻保护剂的细胞毒性,这会极大影响细胞活力。
3. 不建议室温解冻细胞,因为这会导致细胞死亡。
4. 为降低污染风险,水浴解冻时冻存管管口要高于水面,避免水流入冻存管,水浴锅中的无菌水也要定期更换。
5. 细胞解冻后应尽快稀释,以减少 DMSO 的细胞毒性。按照培养基:冻存液 ≥10:1 的比例加入培养基进行稀释,然后离心并更换培养基重悬细胞,这样可以减少由渗透压变化导致的细胞应激。
[常见问题及解答]
1.如何选用细胞系培养基?
优先根据细胞来源公司提供的培养条件,其次参考ATCC推荐细胞对应培养基。一般建议不要随意更换培养基种类。细胞株均有其特定使用且已适应的细胞培养基,若骤然使用与原先提供的培养条件不同的培养基,可能造成细胞形态发生变化或无法存活,以及细胞的表型功能丢失。
2.细胞发生微生物污染时,应如何处理?
直接丢弃或更换,将未受污染的细胞转移至其它培养箱,并用消毒剂消毒培养器皿和超净台以及二氧化碳培养箱。如发生真菌霉菌污染,需用紫外灯照射整个细胞间,从而消除可能产生的孢子。同时排除使用试剂的污染,包括培养基和血清,可以空培试验。
3.为何培养基用一段时间后,颜色偏紫?
培养基随着多次开盖会使培养液CO2 逐渐溢出,造成培养基越来越偏碱性从而变紫,尤其是剩余的培养基越少越容易变紫。可将培养瓶瓶盖旋松放入二氧化碳培养箱校正溶液pH值,过一段时间就会变回正常。变紫的培养基是可以继续使用的,培养细胞时在培养箱会自动恢复颜色。
4.细胞培养液变黄变浑,如何处理?
细胞培养液变黄多半是细胞密度过大,细胞增殖速度过快,产生大量酸性代谢废物,导致细胞营养不足。而培养液变浑多半是发生了细菌污染。出现这种情况应立即进行消化传代处理。
5.血清中出现的沉淀是什么,有影响吗?
①纤维蛋白,是经常出现的较大沉淀物,可达到1-2mm,用肉眼可观察到;
②胆固醇、脂肪酸酯以及一些蛋白质,是血清出现沉淀物的常见原因;
③磷酸钙,也是一种常见沉淀物,通常会使血清出现浑浊,并且在37℃培养时会增加。这种沉淀物在倒置显微镜下观察像小黑点,这些小黑点由于布朗运动看上去可以活动,因此经常被误认为是微生物污染。
这些沉淀对细胞的生长是没有影响的,如想去除沉淀,尽量采用离心方法,不建议使用过滤方法,因为会堵塞滤膜而且会造成污染的风险。
6.细胞何时换液最佳?
①细胞消化传代后,建议隔天或隔两天换一次液;
②细胞传代后,发现碎片多、死细胞多,在细胞形态已经形成的前提下可第二天换液;
③对于生长速度较慢的细胞,可多放点培养基,减少换液次数,让细胞静养;
④细胞传代后,细胞分布不均、细胞堆叠、细胞间隙大、局部密度大,这些情况下不用换液,可采取消化重铺的方式。
7.细胞支原体污染如何处理?
支原体污染是比较难去除的,特别容易复发,一般建议直接更换新的细胞,如特别精贵或重要的细胞可尝试使用四环素、大环内酯类抗生素(泰乐霉素)、喹诺酮类抗生素。
8.如何控制胰酶消化时间?
胰酶消化的程度是细胞培养中的一个关键步骤。消化过度,细胞碎片增多,黑渣子增多,细胞会成片脱落,严重影响细胞活性,导致部分细胞漂浮;消化不足,则细胞难于从瓶壁脱落,反复吹打同样也会损伤细胞活性。
不同细胞对消化液的敏感性不同,胰酶消化的时间也会有差异。像疏松贴壁的293T和Lncap可能1-2min,正常贴壁的Hela和A549可能2-3min,贴壁较牢的HEPG2和CACO-2可能5min,贴壁非常牢的5637和A431可能10min左右。具体消化时间以消化到细胞变圆收缩、细胞间隙变大、轻轻晃动培养瓶能看到细胞呈流沙状即可终止。
9.如何避免血清沉淀物的产生?
①解冻血清时,请按照所建议的逐步解冻法(-20℃至4℃至室温);
②解冻血清时,请随时将之摇晃均匀,使温度及成分均一,减少沉淀的发生;
③请勿将血清置于37℃太久,否则会变混浊,同时许多较不稳定的成分也会因此受到损害,从而影响血清质量。
血清的热灭活非常容易造成沉淀物的增多,若非必要,可无须做此步骤。
10.对细胞形态有疑问?
①确定细胞所使用的培养基种类是否为说明书建议的。改变培养基种类细胞形态可能会有变化;
②以引种公司官网细胞照片为准,其次可以参考ATCC或DSMZ网站的图片;
③如上皮型细胞明显成为成纤维细胞,或成纤维细胞明显成为上皮型细胞,需查看细胞是否提供STR鉴定报告,身份是否正确;
④细胞的代次是否过高导致分化变异、细胞是否经过加药诱导、细胞是否经过转染等都会引起细胞形态发生变化;
⑤细胞低密度和高密度形态不一,还有一些细胞呈现形态较慢,细胞要1-2天才能伸展开。所以细胞的正常形态要等细胞密度起来后才能确定。
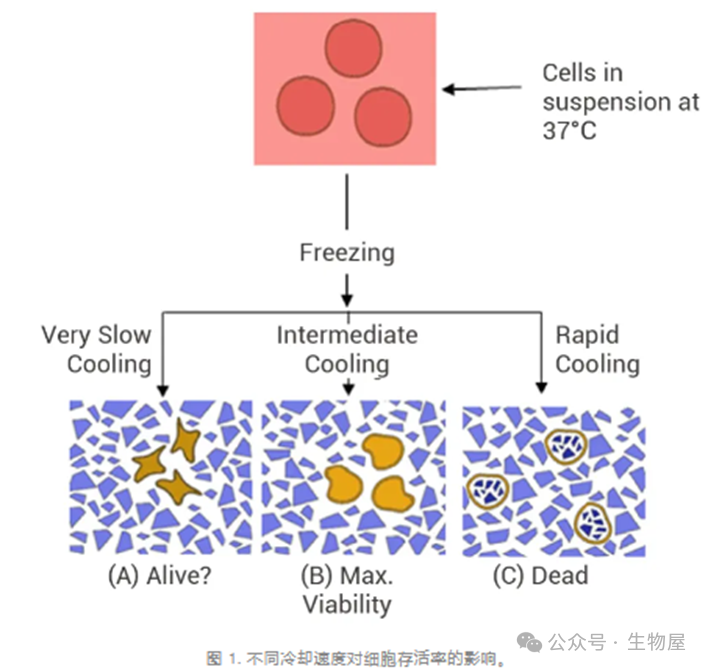
11. 细胞为什么要慢冻速融?
冻存细胞时,细胞内外环境中的水会形成冰晶。如果直接将细胞冻存到 -196℃ 的液氮中,由于冻结过程中胞外溶液中的水先结冰,使胞外溶液不断浓缩,引起细胞电解质升高、渗透压改变、脱水及蛋白质变性等,会导致细胞受到机械性损伤。
随着温度降低,细胞内外的水分也会“结冰”并形成冰晶,冰晶能导致细胞内发生机械损伤、电解质升高、渗透压改变、脱水、pH改变、蛋白变性等,能引起细胞死亡。因此缓慢冷冻,可使细胞逐步脱水,细胞内不致产生大的冰晶,再采用甘油或二甲基亚砜作保护剂,这两种物质能提高细胞膜对水的通透性,加上缓慢冷冻可使细胞内的水分渗出细胞外,减少细胞内冰晶的形成,从而减少由于冰晶形成造成的细胞损伤。
在冷冻保存时,细胞外环境中的水会结冰。冷却速度的不同会导致细胞由于渗透脱水而发生不同程度的收缩。细胞外环境的渗透压随着水结成冰晶而不断升高,冷却速度越慢,细胞内水分通过渗透作用移出细胞的时间就越长。因此,非常缓慢的冷却可能会导致细胞因过度脱水而死亡 (A)。而快速冷却 (C) 会导致细胞内形成冰晶,这会导致细胞在复温时死亡。中间冷却速度 (B) 则可以平衡渗透脱水和细胞内结冰形成的风险,通常可以实现细胞存活率最大化。
如果在冻存液中加入保护剂 (如 DMSO),可使冰点降低,增加细胞渗透压稳定性。减缓慢速降温过程中的脱水皱缩现象,在缓慢冻结时减少冰晶的生成,使细胞免受损伤。
而在复苏时,需要快速升温,在 1-2 min 内融化并稀释,这时细胞内外还来不及形成较大的冰晶,也不会使细胞长时间暴露在高浓度的电解质溶液中,从而避免细胞损伤,提高细胞存活率。
12. 为什么复苏的细胞完全不贴壁?
可能是由于细胞冻存前生长状态差或者复苏过程中动作慢,因此一定要挑选生长状态良好、处于对数生长期的细胞进行冻存,操作过程要遵循“慢冻快融”的原则。
13. 为什么复苏细胞的时候明明已经贴壁了,第二天再去看发现细胞全死了?
可能是细胞冻存之前消化过度,导致细胞凋亡,因此消化细胞时一定要严格控制消化时间。
14.细胞复苏后只有非常少量细胞贴壁,是不是需要重新复苏?
先不要着急丢掉!可以补加血清和细胞因子,或者每隔 2-3 天换新鲜的生长培养基,经过 2-3 次换液后,大部分细胞就能看到明显增殖,此时再按照正常传代操作即可。当然,如果细胞库存充足,或者着急做实验,可以重新复苏一株细胞。
15.冻存液配多了,不想浪费,可以留到下次用吗?
配好的冻存液在4℃ 可以暂存 1 周,在 -20℃ 最多可保存一个月。不过最好还是现配现用、避免反复冻融。
16. 要怎么样复苏细胞?
细胞复苏需要准备一个37℃水浴锅、手套、镊子,以及防护眼镜。戴上手套,用镊子夹住液氮罐中拿出的冻存管,然后快速在37℃水浴锅里融解细胞。防护眼镜可以防止液氮罐里刚刚拿出来的管子液氮爆炸。
17.培养基不够用,能不能换一种细胞培养基?
不能,更换培养条件,细胞可能无法快速适应,导致细胞死亡。
18.能不能换血清呢?
尽量换同一批次的血清,毕竟不同批次的血清,质量不一样,所以可能会有潜在的影响。
19.复苏后应不应该立马去除掉DMSO?
有一些细胞会对DMSO敏感,一般的培养条件来说,复苏后的细胞(含有DMSO)加入完全培养基后培养,一天后再换液,可以避免复苏后细胞的生长和粘附的问题。
20.什么时候需要换液?
这个要根据细胞的生长状态来定,当细胞代谢加快后,应该换液。细胞密度增大后,需要考虑传代。
21.培养基到底要不要加抗生素?
其实是不推荐加抗生素的,但是很多时候,都会为了保险,加上双抗。但双抗只能抗细菌,不能抗真菌。
22.什么时候用5% CO2或10% CO2呢?
主要看的是培养体系,培养基的缓冲体系基本上都是用碳酸氢钠缓冲体系的,培养基里的碳酸氢钠的浓度决定了CO2的量,当碳酸氢钠达到3.7g/L的时候,需要采用10% CO2,当碳酸氢钠达到1.5g/L的时候,需要用5% CO2。如果你用的培养基用的是Hank's balanced salt solution (HBS,Hank缓冲液)的话,就不能用CO2培养箱了,因为这个体系里碳酸氢钠浓度只有0.35g/L。
23.培养基在冰箱里的时候,紫红色的培养基为啥会变暗?
答:培养基没有密封好保存,因为冰箱里没有CO2补充,培养基变成碱性,颜色就暗了。
24.支原体污染是否能肉眼识别?
支原体用肉眼基本很难判别,主要还是通过PCR检测或者是染色检测来区分支原体污染与否的。
25.细胞离心的话要怎么离心?
推荐1000rpm离心5-10分钟,这样比较不容易伤害细胞。
26.复苏后的细胞死亡率高是啥原因?
1)培养基质量差;2)血清质量差;3)复苏后立马离心,导致大量细胞原地爆炸;3)细胞长时间放置在-80℃;4)误把悬浮细胞当做是死细胞。
27.培养基里L-谷氨酰胺的作用?
L-谷氨酰胺的主要作用是在培养细胞的能量来源,参与蛋白质合成和核酸代谢。
28.培养基里的酚红的作用?
酚红一般作为培养基中pH值的指标:当培养基呈中性时为红色,呈酸性时为黄色,碱性时为紫色。另外,酚红可以模拟类固醇激素(特别是雌激素)的作用。如果要避免类固醇反应,可以在无酚红的培养基里进行培养。
29.胰酶里为什么要加EDTA?
二价的离子会抑制胰酶活性,加入EDTA可以螯合掉Ca、Mg这样的二价离子,另外注意胰酶也不要反复冻融。
30. 原代培养、细胞系、细胞株有什么区别?
原代培养是指细胞从组织中分离出来后,在适宜条件下增殖,直到它们占据所有可用的基质(即达到汇合状态)的培养阶段。在此阶段,必须通过将细胞转移到含有新鲜生长培养基的新容器中进行继代培养(即传代),以为其提供更多的继续生长空间。
第一次传代培养后,原代培养物即被称为细胞系。来自于原代培养的细胞系寿命有限(即有限细胞系),随着细胞的传代,生长能力最强的细胞会占据优势,最终导致细胞群体在基因型和表型上达到一定程度的均一性。
如果通过克隆或其他方法从培养物中阳性筛选出了细胞系的亚群,则该细胞系成为一个细胞株。与亲代细胞系起始时相比,细胞株通常会获得一些其他的遗传学改变。
31.有限细胞系与连续细胞系有什么区别?
正常细胞通常只能分裂有限的次数,随后就会丧失增殖能力,这是一种由遗传决定的事件,称之为衰老;此类细胞系被称为有限细胞系。但是,一些细胞系可以通过被称为转化的过程而变为永生化细胞系,该过程可以自发发生,也可以通过化学或病毒诱导而发生。当一个有限的细胞系经历转化并获得无限分裂的能力时,它就成为了一个连续细胞系。
32.悬浮型与贴附型细胞有什么区别?
根据细胞的生长是否需要贴附在支持物上,可将其分为贴附型和悬浮型。
贴附型细胞:大多数培养细胞贴附生长,属于贴壁依赖性细胞。贴附型细胞只能附着于底物(支持物)表面生长,当细胞贴附在支持物上之后,易失去它们在体内时原有的特征,细胞分化现象常变得不显著。在光学显微镜下可将体外培养的贴附型细胞从形态上分为成纤维细胞、上皮样细胞、淋巴母细胞样细胞。

悬浮型细胞:有的细胞在培养时不贴在支持物上,而是悬浮在液体中,呈悬浮状态生长,如HL-60、Jurkat、K562。细胞悬浮生长时胞体呈圆球形。细胞悬浮培养的优点是细胞悬浮在培养液中生长,生存空间大,生长时间长,能繁殖出大量细胞,传代方便,便于做细胞代谢等方面的研究。

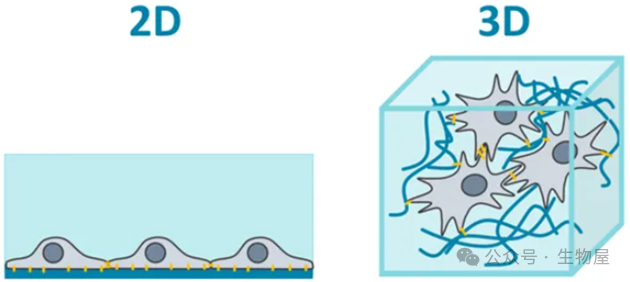
33.2D与3D细胞培养技术有什么区别?
2D平面培养是目前应用最广泛的细胞生物学研究手段,由于只有与培养表面接触的一侧发生细胞吸附,许多细胞从组织中分离并置于平面细胞培养表面时,逐步变得更加扁平,分裂异常,并丧失其分化表型。许多通过2D培养环境获得的细胞生物学行为数据,在相应的动物学模型中不能很好的再现,以2D培养细胞为基础的药物筛选常常遇到体内和体外药效不一致的情况。
而在3D培养中,是一种模拟体内三维生长环境的细胞培养方式。整个细胞表面都可以发生细胞吸附,细胞吸附和伸展的程度影响其增殖、凋亡和分化功能。3D培养可以建立起生理上的细胞-细胞与细胞-细胞外基质相互作用,细胞行为特性更接近于生物体内的生存状态,模拟天然组织的特异性,应用于新药筛选、肿瘤细胞系统生物学、干细胞研究、功能组织植入和其它细胞分析等研究领域。目前应用较多的3D细胞培养的细胞是原代细胞(肝细胞和内皮细胞等)和干细胞。
34.塑料培养瓶与玻璃培养瓶的区别?
对于生长速度慢的细胞如果想要更漂亮的细胞状态,塑料瓶比玻璃瓶会好,对于生长速度慢的细胞,玻璃瓶则会更好。同样,对于同一种细胞,在其生长速度慢的时候,塑料瓶会好一点,比如刚刚复苏的时候,或者原代培养的时候。而在其生长旺盛的时候,玻璃瓶则相对会好一点。
35.培养瓶和培养皿的区别?
主要区别在于安全系数(培养瓶>培养皿)、培养细胞数量(大培养瓶>培养皿)。
36.细胞培养瓶的类型?
细胞培养瓶分密封盖和通气盖两种,可满足不同的实验需求。同时,有贴壁细胞培养瓶、悬浮细胞培养瓶两种系列。贴壁细胞培养是通过特殊的表面处理具有出色的初始粘附性和增殖能力,而悬浮细胞培养能最大限度地减少细胞收集的损伤和损失。
37.细胞培养板如何选择?
细胞培养板可灵活选择通量,并且有多种表面处理方式,包括未处理/TC/PDL包被/low-binding,应用更广泛。培养贴壁细胞,通常是选用平底的,这样便于镜下观测、有明确的底面积、细胞培养液面高度相对一致。培养贴壁细胞可选择TC处理表面,表面未处理适合悬浮细胞培养。
38.购买的复苏细胞,收货后怎么处理?
1)收到细胞后,首先观察培养瓶是否完好,培养瓶是否有破裂,培养基外溢、浑浊等现象,请及时拍照并与商家联系。
2)显微镜下观察细胞形态是否正常,对于贴壁细胞则要注意看贴壁情况是否良好,观察细胞密度,确认细胞无异常(由于运输原因,贴壁细胞会有少量细胞脱落,为正常现象)。
3)用75%酒精对培养瓶表面进行消毒处理,将培养瓶置于细胞培养箱中静置培养3-4小时,以恢复细胞状态,如果细胞密度不高,建议过夜培养。
4)若细胞密度超过80%,则可以根据以下提供的传代步骤进行传代;若细胞密度未达到80%,则先吸除原来培养瓶中大部分的培养基,留下5-10 mL左右,稍微拧松瓶盖,继续放入细胞培养箱中培养,直到细胞密度超过90%时再进行传代。
39.购买的冻存细胞,收货后怎么处理?
收到细胞后,首先观察泡沫箱中干冰是否有剩余,冻存管是否完好,是否有解冻情况,若发现干冰完全汽化或冻存管有解冻现象,请及时拍照并与商家联系。若细胞冻存管正常,可以选择立即按照复苏步骤复苏细胞,或者立即冷冻保存(如24 h内复苏,可存放于-80 ℃冰箱;超过24 h请存放于液氮中),需要时再复苏即可。
40. 如何区分活细胞和死细胞?
显微镜下观察:活细胞中间透亮,饱满,有光泽,死细胞较暗。也可以通过台盼蓝染色来计算细胞活力。
41. 如何用台盼蓝计数活细胞?
用无血清培养基把细胞悬液稀释到 200~2000 个/毫升,在 0.1 毫升的细胞悬液中加入 0.1 毫升的 0.4% 的台盼蓝溶液。轻轻混匀,用血球计数板计数细胞。活细胞排斥台盼蓝,因而染成蓝色的细胞是死细胞,注意计数需在加入台盼蓝 10 min 内完成。有细胞计数仪的,可直接用计数仪进行计数。
42. 细胞为什么生长不均匀?
细胞传代后放入培养箱没有摇匀,或者放入时摇匀,但在细胞贴壁前,又移动了培养瓶,频繁开关培养基引起的振动或者培养基中培养液过少,培养箱搁板表面不平整,这些因素会导致细胞生长不均匀。
43. 有无不受CO2 影响的培养基?
有,如果缓冲体系不是NaHCO3,而是其他体系如 HEPES,就不受 CO2 的影响。
44. 血清灭活是否必须?
一般情况下不建议。热灭活是以56℃,30分钟来处理已解冻的血清,因为此加热步骤,可以使补体去活化。调查显示,经此处理过的血清对细胞的生长只有微小的促进,或完全没有作用,甚至会因为高温处理影响了血清质量,造成细胞生长变慢。经过热处理的血清,沉淀物会显著增多,这些沉淀物在显微镜下观察,像是 "小黑点",会被误以为是血清遭受污染。因此,除了免疫学实验和一些特定细胞,不需要热灭活处理。
45. 冻存液如何配置?都有哪些选择?
冻存液常规配比为培养基:血清:DMSO=7:2:1,细胞状态越好血清比例可越低,但不低于20%。如果细胞比较珍贵或脆弱,可以调整为血清:DMSO=9:1,冻存液应该提前配制,置于室温备用,防止临时配制产生的热量损伤细胞。同时现在也有很多成品的血清冻存液,比如无血清/无蛋白的非程序性冻存液,可以不使用梯度降温或者梯度降温盒,操作方便,同时适用于多种细胞。
46. 细胞在液氮中可以长期保存?
细胞冻存可以使细胞暂时脱离生长状态而将其细胞特性保存起来,细胞储存在液氮中,温度达-196℃,理论上储存时间是无限的。为妥善起见,特别是很多未被冻存过的细胞在首次冻存后要在短期内复苏1次,观察细胞对冻存的适应性。已建系的细胞最好也每年复苏1次后,再继续冻存。
47. 无糖DMEM、低糖DMEM和高糖DMEM有什么区别?
D-葡萄糖(D-Glucose)是细胞生长所需的主要能量来源。使用无糖培养基的主要目的是,通过控制细胞的能量来源,研究细胞的代谢过程或葡萄糖利用效率。低糖型 DMEM 的葡萄糖浓度为 1 g/L,适合培养代谢作用较慢、依赖性贴壁细胞的哺乳动物细胞。高糖型 DMEM 中的葡萄糖浓度为 4.5 g/L,普遍应用于生长快、粘附性低的细胞、杂交瘤的骨髓瘤细胞、克隆细胞、DNA 转染的转化细胞等。
48. 为什么有的培养基的颜色是偏红色的?
因为培养基中添加了酚红(Phenol red)—pH 值指示剂,pH 值低时培养基呈黄色,pH 值高时培养基呈紫色,pH 值 7.2-7.4 时为红色,最适合细胞培养。在一些无血清培养基的配方中酚红会干扰钠-钾平衡培养,干细胞或细胞克隆时倾向于不加酚红。酚红可以模拟固醇类激素的作用(特别是雌激素),在培养雌激素敏感的细胞(如乳腺组织)时,建议使用不含酚红的培养基。酚红的颜色会对流式细胞分析产生一定的干扰,不建议使用含酚红的培养基制备细胞样品。
49. 碳酸氢钠(Sodium bicarbonate)有什么作用?
碳酸氢钠是作为pH缓冲剂使用,pH 6.8-7.8 为细胞生长的最佳 pH 条件,多数培养基利用碳酸氢钠进行缓冲。碳酸氢钠的缓冲需要二氧化碳。高碳酸氢钠 (1.5-3.7g/L) 需要 5-10% 二氧化碳;低碳酸氢钠(0.35g/L) 不需要二氧化碳培养箱。干粉培养基需要在配制时单独添加碳酸氢钠。
50. 如何确保细胞培养基保持最佳性能?
如果细胞培养基已冷藏(2-8℃),使用前恢复室温或者37度预热处理。细胞培养基保持避光储存,暴露于光线会使培养基中细胞生长所需的必需维生素降解。向细胞培养基添加FBS后,请将完全培养基放入冰箱(2-8 ℃)以保持性能。为了减少污染机率和pH值变化的影响,含添加剂的培养基的使用期限建议控制在2-4周内。
51. 血清选择
作为生长和附着因子、激素、脂质和矿物质的来源,血清对于在基础培养基中进行的细胞培养至关重要。此外,血清还调节细胞膜的通透性,且是脂质、酶、微量营养素和微量元素进入细胞的载体。
常见的血清供体动物,主要有牛、马、猪、猴、兔等,其中牛血清是使用最广泛的血清。市场上常见的牛血清,根据血源采集地不同,从血源质量、加工工艺、质控上区分,从优到次排序依次为澳洲、北美、南美、国产。根据采血时间不同,又可以分为胎牛、新生牛、小牛血清,其中胎牛由于还未接触外界,血液中所含抗体、补体等对细胞有害的成分最少,制得血清的质量最高。因此常选胎牛血清(FBS)做增殖细胞用的血清,也用于细胞系和原代培养。
52. 为什么储存在冰箱中的胎牛血清会出现沉淀?怎样避免沉淀物的产生?
絮状物是什么:血清中的沉淀是由纤维蛋白的凝聚产生,对血清质量没有任何影响,沉淀的产生原因很多,高温解冻、剧烈摇晃、反复冻融、常温放置时间过长等都会导致产生沉淀。
解决办法:可用离心3000 rpm,5 分钟去除,也可以不用处理
避免沉淀产生方法(血清解冻方法):
1.温度:请在 2-8℃环境下解冻,过夜;避免高温解冻;
2.方法:解冻过程中可轻柔颠倒摇匀(避免产生气泡),使血清成分和温度混合均匀,避免剧烈摇晃;
3.分装:血清解冻后请进行分装成小体积,每次解冻后的小体积血清请尽快用完,避免反复冻融;
4. 储存:血清不宜在室温放置较长时间,使用时请尽量保持低温,使用后请及时放回 2-8℃暂时保存, 2-8℃保存不超过一个月,长期保存请放置-20℃。
53. DMSO具有抑菌性?
DMSO冷冻保护作用:DMSO可以快速穿透细胞膜进入细胞中,降低冰点、延缓冻存过程,同时提高细胞内离子浓度,减少细胞内冰晶的形成, 从而减少细胞损伤,是目前广泛使用的的细胞冷冻保护剂。
DMSO毒性:DMSO在低温下能保护细胞,但在常温下却对细胞有害,研究结果表明,培养液中DMSO浓度为10%时,细胞生长抑制率近100%;1%浓度时抑制率为35%,即使是0.04%的浓度,DMSO对细胞的生长也有不利的影响。正是因为如此,细胞复苏后需要离心去除DMSO。
DMSO抑菌性:DMSO本身是很好的抑菌剂,DMSO浓度为8%时,可抑制92%的绿脓杆菌生长;浓度15%,能抑制98%的大肠杆菌及巨大芽孢杆菌的生长。2%的DMSO,就能抑制白色念珠菌和酵母菌等多种细菌的生长。
54. 培养基冷冻以后pH会有什么变化?
动物细胞多数需要微碱性环境,pH为7.2~7.4,以不超出6.8~7.6为宜。因此常在培养基内加入NaHCO3(与CO2溶于水后所形成的H2CO3构成一个缓冲对)来调节pH。
培养基冰冻以后,液体里的气体包括CO2便会逸出。原因是水结冰过程中分子倾向于有序排列(形成晶体),其中的气体就会被排出(冰不能溶解气体),所以在冰冻过程中会有气泡形成。
培养基内CO2减少,便会导致培养基pH升高。
55. 培养箱中CO2浓度为什么通常为5%?
CO2作用:细胞培养基为了调节pH而加入的NaHCO3本身具有释放CO2的倾向,加入CO2可以抑制这个反应的进行。培养箱中CO2浓度应与培养液中NaHCO3浓度相平衡,从而抑制培养基内CO2的损耗。也就是说,培养箱内的CO2,最主要的作用就是为了抑制细胞培养基的CO2损耗,同时还有一定的保温作用。因此,理论上来说,培养箱的CO2浓度设置,应该根据具体培养基内加入不同的碳酸氢钠的量来调整,直到该培养基在未培养任何东西的情况下,其CO2可以在培养箱内保持恒定为最科学的浓度。
不同的细胞培养基的NaHCO3浓度不一样,使用不同的细胞培养基应选择与之对应的CO2浓度,以下为一些经验参考:
1)NaHCO3 (g/L)<1.5时,所需CO2浓度为4%;
2)NaHCO3 (g/L)处于1.5左右时,所需CO2浓度为5%;
3)NaHCO3 (g/L) 处于2.2左右时,所需CO2浓度为7%;
4)NaHCO3 (g/L) 在3左右时,所需CO2浓度为10%。
国外常用的培养条件就是,1升培养基里含3克NaCO3,CO2培养箱的浓度是10%。而国内大多数是5%的浓度,相对应的培养基内碳酸氢钠浓度就在1.5g/L左右。
56. PDL和DT的换算
PDL:细胞群体计算公式是用于估计细胞的增殖次数的公式,其中PDL代表“细胞传代次数”(Population Doubling Level)。PDL细胞群体计算公式如下:
PDL = log(Nf/Ni) / log(2)
其中,Nf代表最终细胞数,Ni代表初始细胞数。这个公式基于假设,即每个细胞在每次传代中均分裂成两个新细胞。
DT:细胞倍增时间计算公式是用来估算细胞在特定条件下的倍增时间的公式。该公式可以根据细胞生长曲线的斜率来计算。具体公式如下:
DT = ln(2) / r
其中,DT表示细胞倍增时间,ln(2)是自然对数的底数2的对数,r是细胞生长速率。
换算:PDL=Culture time/DT(例如DT为24h,则一天会增加1个PDL)。
57. 离心力(×g)和每分钟转速(rpm)换算
不同离心机参数的表示方法,常见的有离心力(×g)和每分钟转速(rpm)两种表示方式,现在高档离心机设置有 rpm 和 xg 显示,但多数普通离心机没有自动切换功能。需要用下面的公式进行换算: g=r×11.18×10-6 ×rpm2
上式中 r 为有效离心半径,即从离心机轴心到离心管桶底的长度,单位为厘米。
参考文献
1. Best practices for naming, receiving, and managing cells in culture. In Vitro Cell Dev Biol Anim. 2017, 53(9):761-774.
2. Live and dead cells counting from microscopic trypan blue staining images using thresholding and morphological operation techniques. International Journal of Electrical and Computer Engineering, 2019, 9(4): 2460.
3. Co-occurrence of Cell Lines, Basal Media and Supplementation in the Biomedical Research Literature. Journal of Data and Information Science. 2020, Vol. 5. Issue (3): 161-177.
4. Cell culture medium as an alternative to conventional simulated body fluid. Acta Biomater. 2011, 7(6):2615-22.
5. Mechanism of penicillin-streptomycin synergy for clinical isolates of viridans streptococci. The Journal of infectious diseases, 1986, 154(3): 531-534.
6. Development and Assessment of a Novel Device for the Controlled, Dry Thawing of Cryopreserved Cell Products. BioProcessing Journal. 2016, 15. 30-41.
7. Effects of cell concentration on viability and metabolic activity during cryopreservation. Cryobiology. 1998, 37(2):103-109.

