MINFLUX 背后的一般原理已扩展到其他几种超分辨率显微镜方法。2019 年报道的重复光学选择性曝光 (ROSE) 通过估计发射器相对于移动干涉条纹的相对位置来定位发射器。一年后,研究人员利用正弦照明模式实施了 MINFLUX 概念,创建了 SIMFLUX。这两种技术都很容易兼容大视场成像,并且在相同的光子预算下,定位精度比传统的基于相机的定位提高了两倍。2019 年报道的调制定位 (ModLoc) 显微镜采用了具有移动倾斜干涉条纹的照明调制方法,实现了纳米级的轴向定位精度,并允许在生物样本内进行高达数十微米深度的成像。
Hell 和他的同事在 2021 年推出了 MINSTED。在这个 STED-SMLM 混搭中,MINFLUX 的环形激发光束被环形 STED 光束取代。当荧光团位于圆环孔中间时,荧光团显得最亮。该团队在 2022 年进一步优化了该技术,降低了 STED 光束的功率并进一步提高了空间分辨率。该小组于 11 月发表在《自然生物技术》杂志上的最新研究报道了 MINSTED 实验,该实验以低至 4.7 Å 的精度(略低于半纳米或单个氨基酸的尺度)测量了单个分子的位置。
Sahl 表示:“MINFLUX 和 MINSTED 已经证明,物理学可以实现荧光分子一纳米级或更好的定位精度。在未来几年中,我预测分子长度尺度上任何最后的分辨率障碍都将被打破。”
Leveraging sheets of light
第三类超分辨率显微镜是结构照明显微镜 (SIM),由已故的 Mats Gustafsson 于 2000 年首创。在 SIM 中,两个或多个光束之间的干涉形成用于照亮样品的正弦图案。已知的照明图案和未知的样品结构产生莫尔干涉图案,其频率低于其分量频率。然后通过显微镜对图案进行成像。
SIM 确实超越了阿贝极限,但与 STED 或 SMLM 不同,分辨率增强本质上仅限于两倍,横向分辨率通常徘徊在 100 nm 左右。然而,SIM 的优势在于时间分辨率高、易于使用以及与大多数荧光团兼容。
德克萨斯大学西南医学院细胞生物学系的 Reto Fiolka 表示:“与其他方法相比,SIM 仍然是一种非常流行的方法,因为虽然它没有最高的空间分辨率,但它在空间和时间分辨率之间形成了良好的折衷。已经有研究以视频速率(每秒 24 帧)甚至更快的帧速率研究细胞器动力学,这对于 STED 或定位显微镜来说确实是一个挑战。”
与更高分辨率的同类产品相比,SIM 对活细胞样本的成像也相当温和。然而,当速度很快时,它仍然需要长时间暴露在相对高的光强度下,因为需要具有不同方向和照明图案相位的多个图像来重建最终的超分辨率图像。包括 Gustafsson 实验室前博士后 Fiolka 在内的研究人员一直在寻找降低 SIM 光毒性和光漂白风险的方法。
2022 年,Fiolka 和同事报告了一种称为斜平面 SIM (OPSIM) 的创新方法,他们认为这种方法有潜力将超分辨率显微镜扩展到快速活细胞成像。该技术将 SIM 与光片荧光显微镜 (LSFM) 相结合,后者使用薄薄的光片仅激发焦点体积内的荧光团。每个 3D 图像仅选择性地照亮整个样品一次,因此与共焦显微镜相比,受到的照射量减少了三到五个数量级。
“使用转盘或共焦显微镜,以及 SIM 显微镜,在样品简单漂白之前通常只能对几十个图像体积进行成像,”Fiolka 说。“在某些情况下,使用 LSFM成像数天到数周,获取了数千张图像。”
此外,由于 LSFM 使用相机进行检测,因此可以并行获取数百万个voxels。只需几秒钟即可记录数十到数千张图像,使其能够以比 STED 或 SMLM 高得多的帧速率运行。
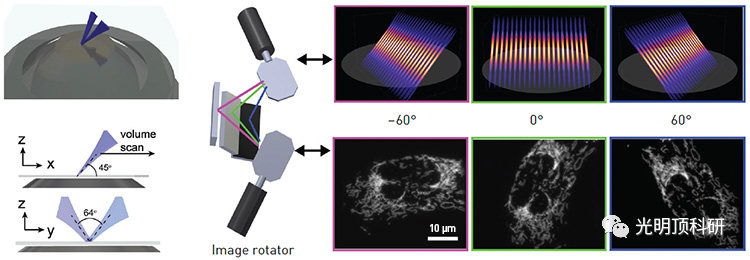
左:在 LSFM-SIM 中,从单个物镜发射的两个光片重叠并产生用于结构照明的干涉图案。右:“图像旋转器”使用振镜来控制结构光片照明,从而实现多次快速拍摄并保持较短的采集时间。
LSFM 的缺点是其空间分辨率适中,横向分辨率通常在 250 nm 至 1 µm 之间。通过与 SIM 相结合,OPSIM 有效地将 LSFM 的分辨率提高了一倍,达到约 150 nm。Fiolka 的团队没有像其他人过去尝试过的那样使用多个物镜,而是开发了一种显微镜,通过从单个物镜以一定角度发射的结构光片来照亮样品。该光片可以旋转以实现SIM所需的多向照明。因此,与传统倒置显微镜一样,样品的获取不受限制。
对荧光纳米球、胶原纤维、组织切片以及癌症和心肌细胞进行的 OPSIM 测试证实,与传统转盘共焦系统相比,其光毒性较低,并且其体积采集速度超过 1 Hz。Schermelleh 指出:“在生物应用和对科学发现的贡献方面,经典的基于干扰的 SIM 方法不断给人带来惊喜,这突显出技术的‘生物相容性’往往会产生影响。”

