脂滴(Lipid Droplets,LDs)具有磷脂单层,围绕由疏水性中性脂质组成的核心。脂滴由内质网产生,表面分布着一组特定的蛋白质,这些蛋白质通过疏水发夹(图1a左)、脂质化结构域和两亲性螺旋或与脂滴表面的另一种蛋白质结合(图1a右)而与单层相关联。在出芽酵母中,脂滴的平均直径为200 nm,而在脂肪细胞分化的早期和晚期,脂滴直径分别约为10和100 mm。
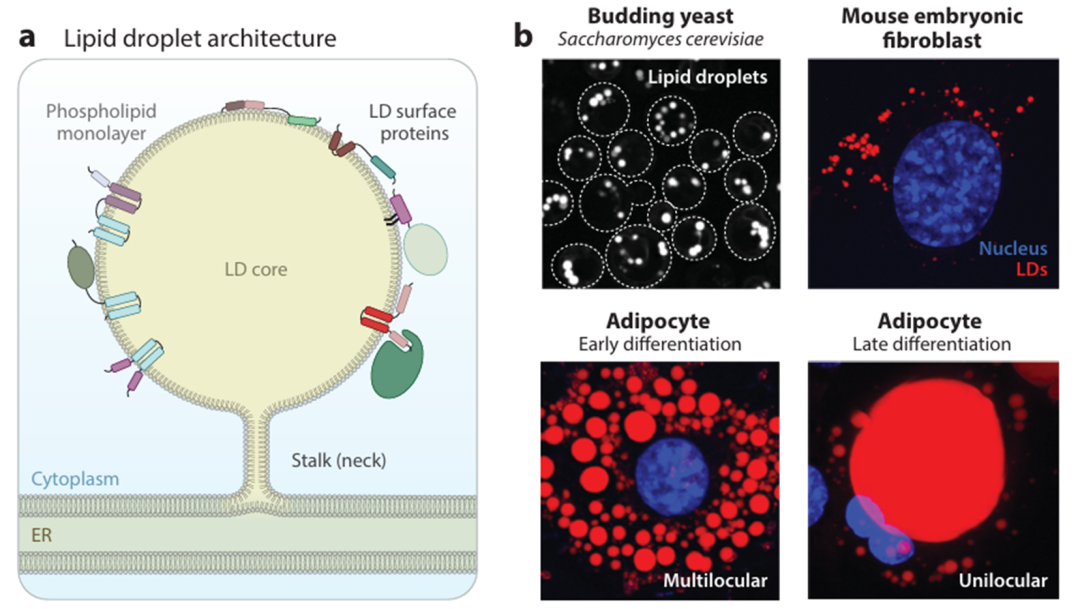
图1 (a)LDs基本结构示意图。(b)通过亲脂性染料(BODIPY)可视化静止出芽酵母细胞中的脂滴分布(虚线表示细胞轮廓)。使用LipidTOX red对胚胎成纤维细胞中的脂滴进行染色[核(蓝色)]。3T3-L1前脂肪细胞分化为脂肪细胞6天(早期分化,多室脂滴)或4周(晚期分化,单室脂滴)。多室脂滴和单室脂滴用LipidTOX red进行可视化。请注意,图像未按比例显示。
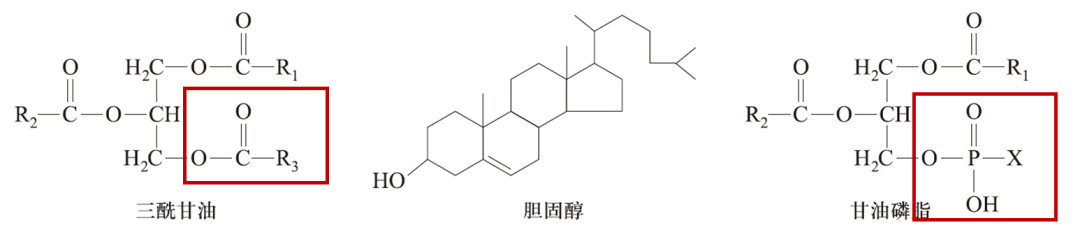
脂类(lipids),又称脂质,包括脂肪和类脂,其共同属性是具有脂溶性。脂肪即三酰甘油(也称甘油三酯)(triacylglycerol,TAG),类脂主要指胆固醇和磷脂。TAG由一个甘油分子和三个脂肪酸形成的酯;人体内含量最多的磷脂是甘油磷脂,即三酰甘油中一个或两个脂肪酸被含磷酸的基团取代的脂类。根据X取代基的不同,甘油磷脂又可分为多种:取代基是胆碱的为卵磷脂,是乙醇胺的为脑磷脂,是丝氨酸的为丝氨酸磷脂。
脂肪酸(fattyacides, FAs)由碳、氢、氧三种元素组成。碳链中不含双键的脂肪酸为饱和脂肪酸(SFA),含有双键的脂肪酸为不饱和脂肪酸。依据碳链中含双键的数目将不饱和脂肪酸分为:① 单不饱和脂肪酸(MUFA),碳链中只含一个双键;② 多不饱和脂肪酸(PUFA),碳链中含两个以上双键。在大多数细胞中,代谢能量以脂肪酸(FAs)的形式储存。根据碳链上第一个双键的位置,不饱和脂肪酸可分为(ω-3、 ω-6等)。直链脂肪酸中距离羧基最远的碳原子称ω碳原子,若从ω 碳原子起(即从甲基端数起)第一个双键在第三和第四碳原子之间的不饱和脂肪酸,称为ω-3系列脂肪酸,以此类推。
图2 EPA和DHA的分子式
1. 脂滴的发生
细胞质脂滴发生涉及合成、成核、胞质出芽和生长(图3①)。(1)成核:三酰甘油(TAGs)在内质网(ER)膜中积累,并在达到临界凝聚浓度(约5–10 mol%)以上时发生相分离,形成透镜结构,随后被BSCL2-Seipin复合物结合。(2)出芽:在LDAF(后生动物)和Ldo45(酵母)的帮助下,LDs向细胞质中出芽。出芽的方向性取决于多种因素,包括FIT2。I类和ERTOLD蛋白可以在此阶段从内质网(ER)进入LD表面。(3)早期扩张:三酰甘油(TAGs)的持续增加导致LD尺寸扩大。其表面通过Seipin复合物(ERTOLD途径)与内质网(ER)形成的连接,增加磷脂和I类蛋白,以及直接从细胞质(CYTOLD途径)中添加II类蛋白和伴侣蛋白辅助的蛋白来生长。(4)晚期扩张:一些脂质滴(LD)表面蛋白(例如,GPAT4和ATGL)被认为在扩张后期才到达LD,它们并非通过Seipin进入表面,而是通过在内质网(ER)和脂质滴(LD)之间形成的桥进入。TAGs的生物合成主要通过“甘油-3-磷酸途径”完成:脂肪酸(FAs)与辅酶A(CoA)结合并被激活,随后与甘油-3-磷酸(G-3-P)酯化,生成溶血磷脂酸(LPA)和磷脂酸(PA)。磷脂酸(PA)去磷酸化生成二酰甘油(DAG),后者继而与第三个脂肪酸(FA)酯化,生成三酰甘油(TAG)。 脂滴不仅是储存单位,也是代谢单位。脂滴的分解代谢有两个主要机制:脂解(lipolysis)和脂肪吞噬(lipophagy)。
Zadoorian A, Du X, Yang H. Lipid droplet biogenesis and functions in health and disease. Nat Rev Endocrinol. 2023 Aug;19(8):443-459. doi: 10.1038/s41574-023-00845-0. Epub 2023 May 23. PMID: 37221402; PMCID: PMC10204695.Klemm RW, Carvalho P. Lipid Droplets Big and Small: Basic Mechanisms That Make Them All. Annu Rev Cell Dev Biol. 2024 Oct;40(1):143-168. doi: 10.1146/annurev-cellbio-012624-031419. PMID: 39356808.
脂滴可视化主要包括下述两种:
(1)基于脂滴包被蛋白(perilipin,PLIN)家族蛋白的免疫荧光定位;
(2)荧光探针。传统染料,如苏丹红III和油红O已用于对 LD 进行染色,但已发现它们在染色过程中会破坏 LD 结构。还可通过荧光染料,如尼罗河红、BODIPY和 LipidTox。
5. 脂滴与线粒体脂滴包被蛋白(perilipin,PLIN)5促进脂肪酸(FA)从脂滴流向线粒体,并在细胞器之间提供物理连接;其同源物PLIN1在脂肪细胞中特异性表达,已被证明与线粒体融合蛋白2 (Mfn2)直接相互作用,而Mfn2是线粒体融合和线粒体-脂滴相互作用的介质。
在骨骼肌中,小G蛋白Rab8a与PLIN5相互作用,调控脂滴与线粒体的接触,并响应AMPK的激活;而饥饿状态下,脂酰辅酶A合成酶FATP4与PLIN5相互作用,增加脂滴与线粒体的接触,二者都能够促进脂肪酸从脂滴转移到线粒体进行β-氧化。
铁(Fe2+)通过与过氧化氢(H2O2)反应被氧化成铁(Fe3+),从而形成高活性的羟基自由基(OH·),称为芬顿反应。Fe3+通过与超氧自由基(O2·-)的反应被还原成Fe2+。这个氧化还原循环被称为HarberWeiss反应。在非酶性脂质过氧化中,自由基,如羟基自由基(OH·),从多不饱和脂肪酸(PUFA)中抽出一个氢,形成一个碳心磷脂(PL)自由基(PL· )。PL.与分子氧(O2)反应,形成磷脂过氧自由基(PLOO·)。PLOO.从另一个PUFA中提取氢,形成磷脂过氧化氢(PLOOH)和一个新的PL.,它可以再次与O2反应。在酶法脂质过氧化中,脂氧酶(LOX)催化PUFAs的二氧化并产生PLOOH。一方面,PLOOH在亚铁(Fe2+)的存在下可以分解成烷氧基磷脂自由基(PLO·),通过攻击另一种PUFA促进脂质过氧化的进一步传播。另一方面,PLOOH可能分解为4-羟基壬烯醛(4-HNE)或丙二醛(MDA),通过交联可能使蛋白质失活。PLs的过氧化和4-HNE或MDA的产生导致膜不稳定和通透性,从而导致细胞死亡。谷胱甘肽过氧化物酶4(GPX4)具有独特的能力,可以将活性PLOOH还原为非活性PL醇(PL-OH),从而中断自由基连锁反应,抑制脂质过氧化。
(1)SystemXc-调控:System Xc-由SLC3A2和SLC7A11二聚体组成,嵌于细胞膜表面。SLC7A11是发挥功能的主要亚基,可将胱氨酸转运入胞,用于合成GSH;因此,抑制SLC7A11表达可诱导铁死亡发生。研究发现,在人肿瘤细胞中SLC7A11过度表达,这种过表达能够抑制活性氧诱导的“铁死亡”,同时削弱p533KR介导的对肿瘤生长的抑制作用。
(2)GSH和GPX4调控:研究认为GPX4是细胞生存的关键,也是铁死亡的核心调控蛋白,GPX4能降解小分子过氧化物和某些脂质过氧化物,抑制脂质过氧化。果不能有效地被Gpx4淬灭,磷脂氢过氧化物能够在过渡金属(如铁)存在的情况下引发催化反应,最终导致细胞死亡。研究发现,若细胞中GPX4 表达下调则会对铁死亡更敏感;敲降GPX4即可诱导铁死亡发生;相反,若上调GPX4 的表达,则会产生对铁死亡的耐受。
(3)ROS调控:诱导铁死亡发生均会导致细胞内脂质ROS升高,从而引起细胞死亡,这也是脂质抗氧化剂可抑制铁死亡的原因。线粒体作为含铁丰富(铁是线粒体氧化呼吸链必需离子)、ROS产生为主的细胞器,被认为是铁死亡发生的重要场所。它既是细胞内产生ROS的重要场所,其脂肪酸代谢又为细胞铁死亡提供特定的脂质前体。p53也能够通过ROS应答和"铁死亡"抑制肿瘤生长。
酸性条件下,PUFA通过促进脂质过氧化,诱导细胞的铁死亡,而脂滴可以吸收PUFA而抵抗酸性环境的细胞毒性;
当酸性癌细胞不能缓冲PUFAs的高水平吸收,并暴露在过氧化的有害影响下时,会促进铁死亡发生;
抑制脂滴的合成有利于PUFA诱导肿瘤的铁死亡;
小鼠肿瘤模型中,高ω-3 PUFA饮食可以增强铁死亡诱导剂对肿瘤的杀伤力。

