全球老龄化浪潮下,衰老研究的意义远不止于延长寿命,它触及人类生存的核心命题与未来的福祉。在科学层面,衰老是众多慢性疾病(如阿尔茨海默症、心血管疾病、癌症、糖尿病等)最主要的共同风险因素。深入理解其生物学机制——从基因调控、细胞损伤修复(如端粒、线粒体功能)、蛋白质稳态失衡到系统性的慢性炎症——不仅是为了揭示生命运行的基本规律,更是为了寻找预防和干预这些“老年病”的根源性策略,将“健康寿命”与“总体寿命”同步延长,让人们拥有更长久、更有活力的晚年;在社会层面,全球人口结构正经历前所未有的老龄化浪潮。有效应对随之而来的医疗负担、照护压力和社会保障挑战,迫切需要衰老科学提供解决方案。延缓衰老相关功能衰退,意味着减少失能、依赖和庞大的医疗支出,释放社会生产力和资源,维护社会经济的可持续发展与代际和谐。从更广阔的视角看,衰老研究是对生命本质的终极探索之一。它关乎人类如何定义“老去”,如何有尊严地面对生命的有限性,以及我们能否在掌握自然规律的基础上,主动塑造一个更健康、更自主、更充实的生命历程。
基于此,本组以“衰老标志物和衰老检测新技术”为题进行文献讨论,本次文献讨论共涉及近一年发表的7篇文献。让我们一起来学习一下吧!
2025年4月份Guido Kroemer等来自全球多个顶尖研究机构,包括巴黎索邦大学、斯坦福大学、哈佛医学院、新加坡国立大学等。于Cell上发表了题为From geroscience to precision geromedicine: Understanding and managing aging的综述文章。该文章深度梳理了衰老科学(geroscience)近年来的研究进展,并进一步提出了精准老年医学(precision geromedicine)的新框架,旨在通过个体化手段延缓衰老、预防多种老年相关疾病,实现健康寿命的延长。衰老的分子机制与“衰老标志(hallmarks of aging)”
研究者基于十余年研究,将衰老归纳为14个“衰老标志”,包括:原始标志:基因组不稳定性、端粒缩短、表观遗传改变等;拮抗标志:营养感应失调、线粒体功能障碍、细胞衰老等;综合性标志:慢性炎症、肠道菌群失衡、细胞间通讯异常等;新增标志(2025年新增):细胞外基质变化和社会心理隔离(图1-1)。
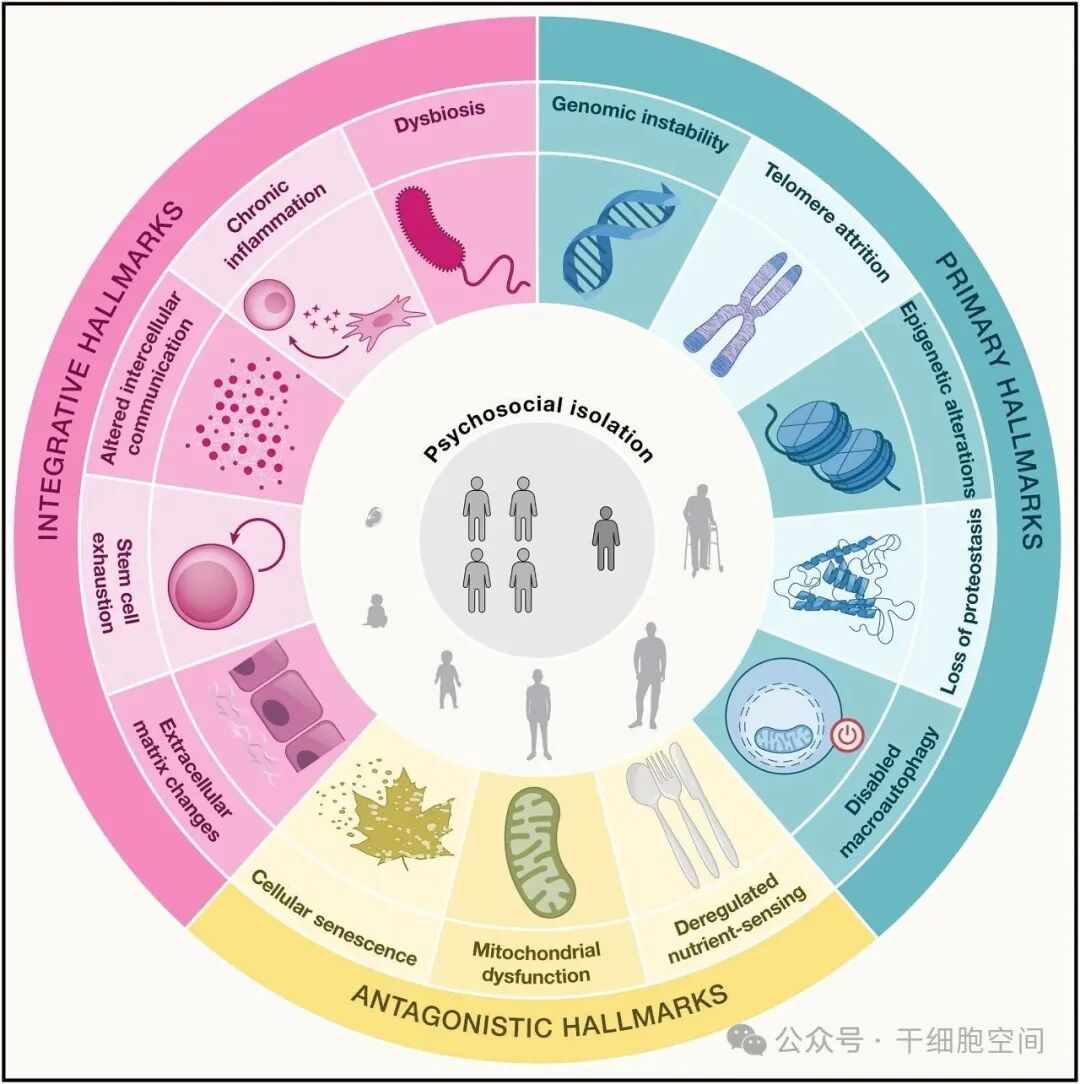 图1-1
图1-1从“基因视角”理解衰老:衰老基因 vs 抗衰老基因
促衰老基因(gerogenes):例如IGF1、DBI、PCSK9等,这些基因的激活会加速衰老过程;抗衰老基因(gerosuppressors):例如APOE ε2、FOXO3A、KL(Klotho)等,它们的表达与健康长寿密切相关(图1-2)。
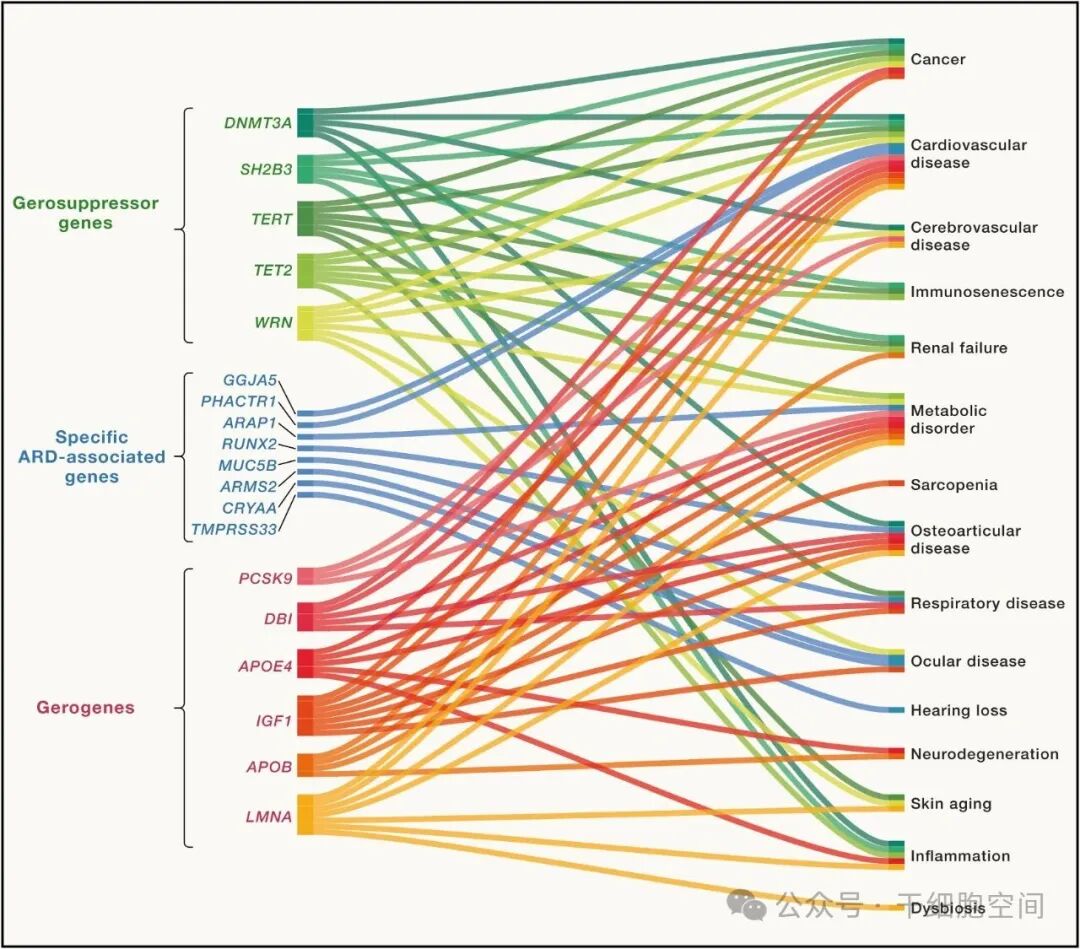 图1-2为了实现个体化干预,作者强调了多组学技术在精准诊断衰老中的重要性:DNA甲基化时钟(epigenetic clock)、血浆蛋白组时钟、代谢组、微生物组、生理功能指标(如握力、肺活量)、数字健康数据。文章汇总了正在开展临床试验的多种“gerotherapeutics”:
图1-2为了实现个体化干预,作者强调了多组学技术在精准诊断衰老中的重要性:DNA甲基化时钟(epigenetic clock)、血浆蛋白组时钟、代谢组、微生物组、生理功能指标(如握力、肺活量)、数字健康数据。文章汇总了正在开展临床试验的多种“gerotherapeutics”:靶点基因 | 药物 | 临床研究方向 |
IGF1 | GLP-1受体激动剂(如semaglutide) | 认知衰退、心衰、糖尿病 |
LMNA | lonafarnib | Progeria早衰综合征 |
LINE-1 | lamivudine(拉米夫定) | 阿尔茨海默病 |
KL(Klotho) | dasatinib+槲皮素组合 | 肺纤维化、骨质疏松 |
这些药物不局限于单一疾病,而是有望对多种老年病产生协同防护效果。1.主动性干预(Proactive):在健康阶段识别风险,延缓衰老;2. 预防性干预(Preventive):发现亚临床病变,阻止疾病发生;3. 拦截性干预(Interceptive):早期识别并处理无症状病灶。论文通讯作者Guido Kroemer强调:“当我们能像治疗癌症一样精准调控衰老基因时,人类健康寿命的延长将不再是梦想。” 随着14大衰老标志的明确和基因靶向药物的突破,延缓衰老相关疾病的新纪元正在开启。2024年11月份刘光慧等来自中国科学院等科研机构的顶尖团队和华大基因合作于Cell上发表了题目为Spatial transcriptomic landscape unveils immunoglobin-associated senescence as a hallmark of aging的文章。本篇文章通过空间转录组学技术,深入探讨了衰老过程中免疫球蛋白(IgG)在多种组织中累积的现象,并揭示了这一现象如何加剧衰老。研究表明,免疫球蛋白相关的衰老现象(Immunoglobulin-associated senescence, IASP)是衰老的重要标志,可能成为未来抗衰老干预的关键靶点。研究团队通过空间转录组学技术,对老年小鼠的九种不同组织(包括大脑、心脏、肝脏等)进行详细的基因表达分析。研究发现,衰老导致组织的“结构熵”(OSE)显著增加,即细胞的空间组织性和功能性出现明显紊乱。同时,衰老组织中免疫细胞的聚集,特别是免疫球蛋白G(IgG)阳性细胞的增多,成为衰老过程中的重要特征(图2-1)。免疫球蛋白,特别是IgG,在衰老过程中在各个组织中累积,并在衰老相关的免疫微环境中发挥重要作用。研究者发现,免疫球蛋白通过诱导巨噬细胞和小胶质细胞的衰老,促进了组织的炎症反应和衰老进程。这一发现使得免疫球蛋白成为了衰老的一个新型生物标志物。通过对免疫球蛋白相关基因的空间定位分析,文章指出,免疫球蛋白产生的细胞(如浆细胞)主要聚集在衰老敏感的“衰老热点”(SSS)区域,这些区域的细胞在衰老过程中表现出较高的免疫活性和炎症反应。免疫球蛋白与衰老细胞之间的紧密关系揭示了它们在衰老进程中的双重作用:一方面它们是免疫系统的重要组成部分,另一方面,过量的免疫球蛋白积累会促进细胞衰老和慢性炎症的发生(图2-2)。文章进一步探讨了通过减少免疫球蛋白的积累来延缓衰老的可能性。研究表明,通过抗体介导的去除免疫球蛋白,或通过抗免疫球蛋白的治疗,能够有效减缓衰老小鼠的衰老进程,并改善多种衰老相关疾病的症状。这一发现为未来开发抗衰老药物提供了新思路。最重要的是,这项研究的发现不仅在小鼠中得到验证,还发现人类的多个衰老组织(如淋巴结、肝脏、脾脏等)中同样存在免疫球蛋白的积累。这为衰老研究提供了一个新的视角,免疫球蛋白相关衰老现象可能是一个物种普遍的衰老标志,具有广泛的临床应用前景(图2-3)。该研究通过空间转录组学技术深入探讨了衰老的细胞与分子机制,揭示了免疫球蛋白在衰老过程中起着至关重要的作用。免疫球蛋白的积累不仅加速了衰老,还可能是衰老过程中一种重要的生物标志物。未来的研究可以进一步开发针对免疫球蛋白的治疗策略,为抗衰老药物的开发提供新的理论依据。2025年1月中山大学陈裕明团队、西湖大学郑钜圣和西湖大学郭天南团队合作于Nature metabolism发表题目为Longitudinal serum proteome mapping reveals biomarkers for healthy ageing and related cardiometabolic diseases的文献。衰老伴随着分子、细胞和器官功能的进行性衰退,增加患病风险。血液作为反映全身状态的“窗口”,蕴含丰富的蛋白质信息,是寻找衰老和疾病生物标志物的理想来源。研究分析了来自广州营养与健康研究(GNHS)队列3796名中老年人(平均基线年龄~57岁)在9年随访期间3个时间点的7565份血清样本。利用质谱技术,研究者成功量化了400余种血清蛋白。通过分析蛋白质水平随时间的变化趋势,并锁定86个衰老核心蛋白:利用线性混合模型,研究者严格筛选出86个血清蛋白,其水平在长达9年的随访期内与年龄增长呈现显著且一致的相关性。研究者采用随机森林机器学习算法,从86个衰老蛋白中筛选出最重要的22个蛋白,构建了PHAS。该评分能有效区分基线时的“健康”(无14种老年病)与“非健康”参与者,在验证集中的曲线下面积(AUC)达0.70。较高的PHAS值与更优的临床表型(如更低的腰围、尿酸、血脂、血糖)存在显著的纵向关联。预测疾病风险:基线PHAS每增加1个标准差,随访期间患任何慢性病的总体风险降低72%。发现关键调节因素—肠道菌群:研究者深入探讨了影响PHAS及22个关键蛋白的因素(内在因素、生活方式、饮食、肠道菌群、宿主遗传)。对于PHAS本身,内在因素(7.0%)和肠道菌群(6.3%)解释了最大的方差比例,远高于生活方式(0.1%)和饮食(0.5%)。基于贡献菌种构建的“菌群评分”与PHAS呈显著正相关(GNHS发现队列:β=0.65, P=4.30×10⁻¹⁹;外部验证队列:β=0.79, P=4.64×10⁻²),强烈提示肠道菌群是调节PHAS的关键且可干预的因素(图3-1)。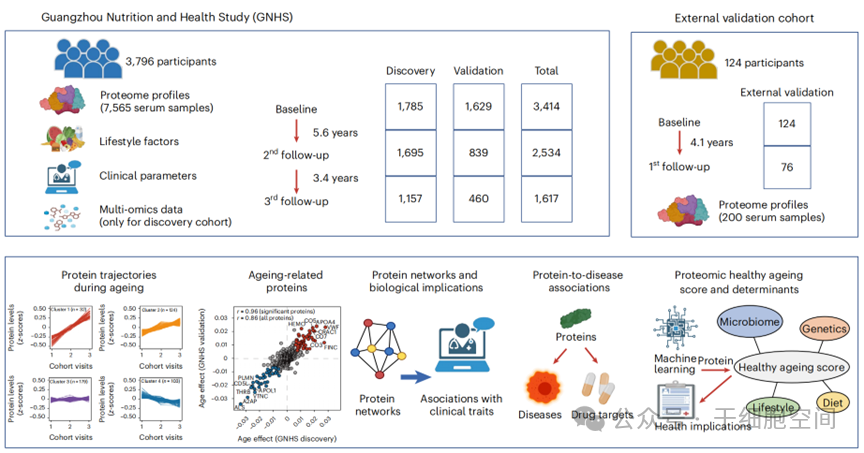 图3-1这项历时9年、涵盖近4000人、分析超7500份样本的大型纵向研究,成功绘制了人类衰老过程中的血清蛋白质组动态图谱,鉴定出核心的衰老相关蛋白及其与健康的紧密联系。基于此构建的“蛋白质组健康衰老评分(PHAS)”是预测心脏代谢疾病风险的有力工具。此外,研究揭示了肠道菌群在调节这一健康衰老指标中的关键作用,为未来通过靶向菌群等途径干预衰老进程、促进健康老龄化提供了重要的科学依据和潜在靶点。2025年5月,来自美国贝勒医学院的李红杰等团队在Neuron发表了题为Distinct systemic impacts of Aβ42 and Tau revealed by whole-organism snRNA-seq的研究,他们利用全生物单核RNA测序技术,首次在果蝇AD模型中系统比较了两种关键致病蛋白Aβ42和Tau对全身不同组织的差异化影响。这项研究不仅揭示了AD的全身性病理机制,还为未来的精准治疗提供了全新视角。研究团队分别在果蝇神经元中特异性表达人类Aβ42或Tau蛋白以模拟阿尔茨海默病(AD)的核心病理特征。通过单细胞核转录组测序数据分析,比较全身219种细胞类型,发现Aβ42和Tau有非常明显的的差异化影响(图4-1)。在Aβ42果蝇中,感觉神经元表现出显著的转录组紊乱,可能与AD早期的感官功能异常(如嗅觉丧失)相关。研究鉴定出一个高表达乳酸脱氢酶(LDH)的特殊LDH-high神经元亚群,该群体在小鼠和人类AD数据中同样存在,提示其可能作为AD的生物标志物或治疗靶点。与Aβ42不同,Tau破坏外周代谢,引发加速衰老。Tau果蝇的肠道、脂肪体和生殖系统表现出与衰老类似的转录组变化,提示Tau可能通过某种信号机制加速外周组织衰老。脂肪代谢异常在Tau果蝇和小鼠模型中均被证实,支持“代谢紊乱促进AD进展”的假说(图4-2)。这项研究颠覆了AD仅是脑部疾病的传统观念,为理解脑-体交互打开了新大门,同时也为临床研究和诊断提供了新的思路。2024年10月,来自中国科学院的周斌等团队在国际顶级期刊Cell发表了题为Identifying specific functional roles for senescence across cell types的研究,传统观点认为衰老细胞积累是衰老和多种疾病(如纤维化、神经退行性疾病)的驱动因素,清除它们(Senolysis)具有治疗潜力。然而,近年研究发现衰老细胞在某些生理过程(如胚胎发育、伤口愈合)中也有积极作用。关键问题在于:不同组织、不同类型的衰老细胞,其命运和功能是否相同?以往的研究手段无法区分不同类型的衰老细胞,只能“一锅端”地清除,限制了对其特异性功能的深入理解和对潜在副作用的评估,而p16Ink4a基因是广泛使用的衰老标志物。为了解决细胞类型特异性的难题,周斌团队开发了四套基于双重组酶(Cre/Dre)交叉遗传策略的创新工具系统(图5-1)。Sn-pTracer (Senescent cells-pulse-chase-tracer):用于脉冲-追踪特定细胞类型的p16Ink4a+细胞命运。原理:利用细胞类型特异的Dre驱动子和p16启动子驱动的CreER,在Tamoxifen诱导下,仅在同时表达Dre和CreER的p16+特定细胞类型中永久标记tdTomato (tdT),实现长期追踪。Sn-cTracer(Senescent cells-Cre-induced-tracer):用于特异性清除特定细胞类型的p16Ink4a+细胞。原理:利用细胞类型特异的Cre驱动子激活p16启动子驱动的Dre表达,进而激活表达白喉毒素受体(DTR)的报告基因。给予白喉毒素(DT)即可精准清除该特定细胞类型的p16+细胞。Sn-gTracer(Senescent cells-gene manipulation-tracer):用于在特定细胞类型的p16Ink4a+细胞中进行基因操控(如过表达或敲除)。原理:结合细胞类型特异的DreER和p16启动子调控的Cre活性,最终在目标细胞中实现对floxed目的基因的操作。p16-tdT 报告小鼠:将tdTomato报告基因插入内源性Cdkn2a (p16Ink4a)基因位点,直接可视化p16+细胞,用于鉴定和表征不同器官、不同年龄以及疾病状态下p16+细胞的类型和异质性。研究人员利用这些强大的工具,以肝脏纤维化(由CCl4或CDAA饮食诱导)为模型,深入探究了不同衰老细胞类型的功能:鉴定主要衰老细胞类型:通过p16-tdT小鼠和单细胞测序(scRNA-seq)发现,在肝纤维化中,主要的p16+细胞类型是巨噬细胞 (Macrophages) 和内皮细胞 (Endothelial Cells, ECs),而肝细胞本身很少衰老;Sn-pTracer追踪巨噬细胞 (SnMo-pTracer):在损伤期标记的衰老巨噬细胞 (p16+F4/80+),在随后的修复期(停止损伤后8周)几乎全部消失,被新生的非衰老细胞替代。Sn-pTracer追踪内皮细胞 (SnEC-pTracer):在损伤期标记的衰老内皮细胞 (p16+CDH5+),在修复期大部分存活下来。重要的是,这些存活的细胞失去了衰老标志(SA-β-Gal降低,SASP减少)并恢复了增殖能力,提示其衰老状态可能是可逆的(图5-2)。清除衰老巨噬细胞 (SnMo-cTracer + DT) 改善纤维化特异性清除p16+巨噬细胞显著减轻了肝损伤和纤维化(纤维化面积、胶原沉积、肌成纤维细胞标志物表达均降低)。机制上,清除衰老巨噬细胞促进了肝脏微环境中T细胞和NK细胞的活化和增殖,这些细胞有助于限制纤维化。清除衰老内皮细胞 (SnEC-cTracer + DT) 加重纤维化令人意外的是,特异性清除p16+内皮细胞反而加剧了肝损伤和纤维化(纤维化指标显著升高)。机制上,清除衰老内皮细胞导致促纤维化信号通路(如成纤维细胞增殖、胶原形成)上调,抑制了抗纤维化通路(如胶原降解)。“重启”衰老内皮细胞 (SnEC-gTracer) 改善纤维化基于发现衰老内皮细胞中促血管生成和修复的关键受体Kdr (VEGFR2) 表达下调,研究者在p16+内皮细胞中特异性过表达Kdr。这成功“重启”了这些细胞(降低SASP,提高增殖能力),促进了血管生成,并显著减轻了肝纤维化(图5-3)。综上所述,研究人员开发了一套强大的遗传学工具包,首次实现了在体内对特定细胞类型的衰老细胞进行精确追踪、清除和操控,并惊人地发现:在肝脏损伤中,衰老的巨噬细胞加剧纤维化,而衰老的内皮细胞反而具有修复功能,靶向“重启”后者能显著改善肝纤维化。2025年2月,德国科学家Gaurav Ahuja团队于Cell Reports中发表了题为scCamAge: A context-aware prediction engine for cellular age, aging-associated bioactivities, and morphometrics的研究;2024年4月,来自北京大学的韩敬东团队于Cell Metabolism中发表了题为Single-cell senescene identification reveals senescene heterogeneity,trajectory, and modulators的研究;这两篇文章分别聚焦于细胞衰老的研究工具——scCamAge 和 SenCID。尽管这两篇文章的研究重点有所不同,但它们都为我们提供了更加深入的衰老研究视角,尤其是在细胞层面的衰老机制与衰老相关生物活动的研究方面。scCamAge 是一款基于人工智能(AI)的工具,旨在通过单细胞显微图像、细胞形态学测量和衰老相关生物活动的预测,提供对细胞衰老过程的准确评估。传统的衰老研究往往依赖于生化测定或基因标记物来检测衰老,但这些方法难以捕捉到衰老的动态变化和空间异质性。而 scCamAge 通过结合显微图像、细胞形态学特征和衰老相关的生物活动(如线粒体功能障碍、活性氧水平、蛋白质稳态和基因组不稳定性等),为衰老研究提供了一种全新的分析框架。在研究过程中,scCamAge 被训练使用了超过一百万个酿酒酵母细胞的单细胞数据,经过严格的验证,包括使用促衰老药物和基因突变模型进行测试。研究发现,尽管 scCamAge 仅在酿酒酵母细胞上进行训练,但它也能够有效预测人类成纤维细胞的衰老,展示了衰老表型在不同物种间的进化保守性。这一发现为跨物种的衰老研究提供了新的视角,并表明该工具具有很高的跨物种适用性(图6-1)。此外,scCamAge 还能预测细胞在衰老过程中表现出的生物活动,如衰老细胞中活性氧(ROS)的变化、线粒体的动态变化、液泡形态的变化等。通过这些生物活动的预测,scCamAge 能够为衰老机制的深入研究提供数据支持。该工具的优势在于它能够实现自动化的细胞形态学计算,并且通过迁移学习框架,能够适应不同的实验数据,使其在衰老研究中具有广泛的应用潜力。
图3-1这项历时9年、涵盖近4000人、分析超7500份样本的大型纵向研究,成功绘制了人类衰老过程中的血清蛋白质组动态图谱,鉴定出核心的衰老相关蛋白及其与健康的紧密联系。基于此构建的“蛋白质组健康衰老评分(PHAS)”是预测心脏代谢疾病风险的有力工具。此外,研究揭示了肠道菌群在调节这一健康衰老指标中的关键作用,为未来通过靶向菌群等途径干预衰老进程、促进健康老龄化提供了重要的科学依据和潜在靶点。2025年5月,来自美国贝勒医学院的李红杰等团队在Neuron发表了题为Distinct systemic impacts of Aβ42 and Tau revealed by whole-organism snRNA-seq的研究,他们利用全生物单核RNA测序技术,首次在果蝇AD模型中系统比较了两种关键致病蛋白Aβ42和Tau对全身不同组织的差异化影响。这项研究不仅揭示了AD的全身性病理机制,还为未来的精准治疗提供了全新视角。研究团队分别在果蝇神经元中特异性表达人类Aβ42或Tau蛋白以模拟阿尔茨海默病(AD)的核心病理特征。通过单细胞核转录组测序数据分析,比较全身219种细胞类型,发现Aβ42和Tau有非常明显的的差异化影响(图4-1)。在Aβ42果蝇中,感觉神经元表现出显著的转录组紊乱,可能与AD早期的感官功能异常(如嗅觉丧失)相关。研究鉴定出一个高表达乳酸脱氢酶(LDH)的特殊LDH-high神经元亚群,该群体在小鼠和人类AD数据中同样存在,提示其可能作为AD的生物标志物或治疗靶点。与Aβ42不同,Tau破坏外周代谢,引发加速衰老。Tau果蝇的肠道、脂肪体和生殖系统表现出与衰老类似的转录组变化,提示Tau可能通过某种信号机制加速外周组织衰老。脂肪代谢异常在Tau果蝇和小鼠模型中均被证实,支持“代谢紊乱促进AD进展”的假说(图4-2)。这项研究颠覆了AD仅是脑部疾病的传统观念,为理解脑-体交互打开了新大门,同时也为临床研究和诊断提供了新的思路。2024年10月,来自中国科学院的周斌等团队在国际顶级期刊Cell发表了题为Identifying specific functional roles for senescence across cell types的研究,传统观点认为衰老细胞积累是衰老和多种疾病(如纤维化、神经退行性疾病)的驱动因素,清除它们(Senolysis)具有治疗潜力。然而,近年研究发现衰老细胞在某些生理过程(如胚胎发育、伤口愈合)中也有积极作用。关键问题在于:不同组织、不同类型的衰老细胞,其命运和功能是否相同?以往的研究手段无法区分不同类型的衰老细胞,只能“一锅端”地清除,限制了对其特异性功能的深入理解和对潜在副作用的评估,而p16Ink4a基因是广泛使用的衰老标志物。为了解决细胞类型特异性的难题,周斌团队开发了四套基于双重组酶(Cre/Dre)交叉遗传策略的创新工具系统(图5-1)。Sn-pTracer (Senescent cells-pulse-chase-tracer):用于脉冲-追踪特定细胞类型的p16Ink4a+细胞命运。原理:利用细胞类型特异的Dre驱动子和p16启动子驱动的CreER,在Tamoxifen诱导下,仅在同时表达Dre和CreER的p16+特定细胞类型中永久标记tdTomato (tdT),实现长期追踪。Sn-cTracer(Senescent cells-Cre-induced-tracer):用于特异性清除特定细胞类型的p16Ink4a+细胞。原理:利用细胞类型特异的Cre驱动子激活p16启动子驱动的Dre表达,进而激活表达白喉毒素受体(DTR)的报告基因。给予白喉毒素(DT)即可精准清除该特定细胞类型的p16+细胞。Sn-gTracer(Senescent cells-gene manipulation-tracer):用于在特定细胞类型的p16Ink4a+细胞中进行基因操控(如过表达或敲除)。原理:结合细胞类型特异的DreER和p16启动子调控的Cre活性,最终在目标细胞中实现对floxed目的基因的操作。p16-tdT 报告小鼠:将tdTomato报告基因插入内源性Cdkn2a (p16Ink4a)基因位点,直接可视化p16+细胞,用于鉴定和表征不同器官、不同年龄以及疾病状态下p16+细胞的类型和异质性。研究人员利用这些强大的工具,以肝脏纤维化(由CCl4或CDAA饮食诱导)为模型,深入探究了不同衰老细胞类型的功能:鉴定主要衰老细胞类型:通过p16-tdT小鼠和单细胞测序(scRNA-seq)发现,在肝纤维化中,主要的p16+细胞类型是巨噬细胞 (Macrophages) 和内皮细胞 (Endothelial Cells, ECs),而肝细胞本身很少衰老;Sn-pTracer追踪巨噬细胞 (SnMo-pTracer):在损伤期标记的衰老巨噬细胞 (p16+F4/80+),在随后的修复期(停止损伤后8周)几乎全部消失,被新生的非衰老细胞替代。Sn-pTracer追踪内皮细胞 (SnEC-pTracer):在损伤期标记的衰老内皮细胞 (p16+CDH5+),在修复期大部分存活下来。重要的是,这些存活的细胞失去了衰老标志(SA-β-Gal降低,SASP减少)并恢复了增殖能力,提示其衰老状态可能是可逆的(图5-2)。清除衰老巨噬细胞 (SnMo-cTracer + DT) 改善纤维化特异性清除p16+巨噬细胞显著减轻了肝损伤和纤维化(纤维化面积、胶原沉积、肌成纤维细胞标志物表达均降低)。机制上,清除衰老巨噬细胞促进了肝脏微环境中T细胞和NK细胞的活化和增殖,这些细胞有助于限制纤维化。清除衰老内皮细胞 (SnEC-cTracer + DT) 加重纤维化令人意外的是,特异性清除p16+内皮细胞反而加剧了肝损伤和纤维化(纤维化指标显著升高)。机制上,清除衰老内皮细胞导致促纤维化信号通路(如成纤维细胞增殖、胶原形成)上调,抑制了抗纤维化通路(如胶原降解)。“重启”衰老内皮细胞 (SnEC-gTracer) 改善纤维化基于发现衰老内皮细胞中促血管生成和修复的关键受体Kdr (VEGFR2) 表达下调,研究者在p16+内皮细胞中特异性过表达Kdr。这成功“重启”了这些细胞(降低SASP,提高增殖能力),促进了血管生成,并显著减轻了肝纤维化(图5-3)。综上所述,研究人员开发了一套强大的遗传学工具包,首次实现了在体内对特定细胞类型的衰老细胞进行精确追踪、清除和操控,并惊人地发现:在肝脏损伤中,衰老的巨噬细胞加剧纤维化,而衰老的内皮细胞反而具有修复功能,靶向“重启”后者能显著改善肝纤维化。2025年2月,德国科学家Gaurav Ahuja团队于Cell Reports中发表了题为scCamAge: A context-aware prediction engine for cellular age, aging-associated bioactivities, and morphometrics的研究;2024年4月,来自北京大学的韩敬东团队于Cell Metabolism中发表了题为Single-cell senescene identification reveals senescene heterogeneity,trajectory, and modulators的研究;这两篇文章分别聚焦于细胞衰老的研究工具——scCamAge 和 SenCID。尽管这两篇文章的研究重点有所不同,但它们都为我们提供了更加深入的衰老研究视角,尤其是在细胞层面的衰老机制与衰老相关生物活动的研究方面。scCamAge 是一款基于人工智能(AI)的工具,旨在通过单细胞显微图像、细胞形态学测量和衰老相关生物活动的预测,提供对细胞衰老过程的准确评估。传统的衰老研究往往依赖于生化测定或基因标记物来检测衰老,但这些方法难以捕捉到衰老的动态变化和空间异质性。而 scCamAge 通过结合显微图像、细胞形态学特征和衰老相关的生物活动(如线粒体功能障碍、活性氧水平、蛋白质稳态和基因组不稳定性等),为衰老研究提供了一种全新的分析框架。在研究过程中,scCamAge 被训练使用了超过一百万个酿酒酵母细胞的单细胞数据,经过严格的验证,包括使用促衰老药物和基因突变模型进行测试。研究发现,尽管 scCamAge 仅在酿酒酵母细胞上进行训练,但它也能够有效预测人类成纤维细胞的衰老,展示了衰老表型在不同物种间的进化保守性。这一发现为跨物种的衰老研究提供了新的视角,并表明该工具具有很高的跨物种适用性(图6-1)。此外,scCamAge 还能预测细胞在衰老过程中表现出的生物活动,如衰老细胞中活性氧(ROS)的变化、线粒体的动态变化、液泡形态的变化等。通过这些生物活动的预测,scCamAge 能够为衰老机制的深入研究提供数据支持。该工具的优势在于它能够实现自动化的细胞形态学计算,并且通过迁移学习框架,能够适应不同的实验数据,使其在衰老研究中具有广泛的应用潜力。SenCID:揭示衰老异质性的单细胞分析工具
SenCID 主要致力于通过单细胞RNA测序数据识别和分析衰老细胞。SenCID 是一种基于机器学习的工具,它通过对 52 个衰老相关数据集(包括 602 个样本,30 种细胞类型)进行训练,成功识别出六种不同的衰老身份(Senescence Identities,简称 SID)(图6-2)。这些衰老身份反映了不同细胞类型在衰老过程中的异质性,即不同细胞类型在衰老过程中表现出不同的基因表达特征和生理反应。SenCID 的优势在于它能够揭示衰老细胞的多样性,这对于衰老的治疗和干预至关重要。研究表明,衰老细胞的反应不仅受到细胞类型的影响,还与衰老的诱导方式(如自然衰老、慢性疾病或衰老相关药物治疗)密切相关。通过应用 SenCID,研究人员能够重建衰老的轨迹,分析不同衰老诱导条件下细胞的基因表达变化,进一步揭示衰老调控因子的层次结构。SenCID 还具有重要的临床意义,因为它能够帮助识别衰老细胞在衰老相关疾病(如肺纤维化、过敏性肺炎等)中的作用。通过对不同衰老类型的分析,SenCID 还能够揭示衰老细胞对衰老清除药物(如 senolytics)的敏感性,从而为衰老治疗药物的开发提供数据支持。综上所述,scCamAge 和 SenCID 这两款工具在细胞衰老研究领域具有重要意义。scCamAge 利用图像分析提供了对衰老过程的动态预测,而 SenCID 通过单细胞RNA测序揭示了衰老的异质性和调控因子。这些工具的创新性使得细胞衰老的研究更加精确、全面,为衰老相关疾病的治疗和药物开发提供了新的思路和方法。至2050年全球60岁以上人口将达21亿,中国百岁老人数量已突破6万。衰老研究通过延长“健康寿命”(Healthspan),可降低失能照护成本、释放社会经济活力——牛津大学模型显示,将健康寿命延长2.5年,可为全球经济节省7.1万亿美元。衰老不仅伴随着身体功能的逐渐衰退,还导致多种老年疾病的发生,如阿尔茨海默病、心血管疾病、糖尿病等,这些疾病不仅增加了患者的痛苦,也给社会带来巨大的经济负担。因此,衰老研究不仅是生物学的前沿领域,也是提高人类健康和福祉的重要途径。
撰写 | 邱 焕 璐、赵 朔、刘 睿 睿、石 梦 迪
排版 | 石 梦 迪
1. Kroemer G, Maier AB, Cuervo AM, Gladyshev VN, Ferrucci L, Gorbunova V, Kennedy BK, Rando TA, Seluanov A, Sierra F, Verdin E, López-Otín C. From geroscience to precision geromedicine: Understanding and managing aging. Cell. 2025 Apr 17;188(8):2043-2062.
2. Ma S, Ji Z, Zhang B, Geng L, Cai Y, Nie C, Li J, Zuo Y, Sun Y, Xu G, Liu B, Ai J, Liu F, Zhao L, Zhang J, Zhang H, Sun S, Huang H, Zhang Y, Ye Y, Fan Y, Zheng F, Hu J, Zhang B, Li J, Feng X, Zhang F, Zhuang Y, Li T, Yu Y, Bao Z, Pan S, Rodriguez Esteban C, Liu Z, Deng H, Wen F, Song M, Wang S, Zhu G, Yang J, Jiang T, Song W, Izpisua Belmonte JC, Qu J, Zhang W, Gu Y, Liu GH. Spatial transcriptomic landscape unveils immunoglobin-associated senescence as a hallmark of aging. Cell. 2024 Nov 27;187(24):7025-7044.e34.
3. Tang J, Yue L, Xu Y, Xu F, Cai X, Fu Y, Miao Z, Gou W, Hu W, Xue Z, Deng K, Shen L, Jiang Z, Shuai M, Liang X, Xiao C, Xie Y, Guo T, Chen YM, Zheng JS. Longitudinal serum proteome mapping reveals biomarkers for healthy ageing and related cardiometabolic diseases. Nat Metab. 2025 Jan;7(1):166-181.
4. Park YJ, Lu TC, Jackson T, Goodman LD, Ran L, Chen J, Liang CY, Harrison E, Ko C, Chen X, Wang B, Hsu AL, Ochoa E, Bieniek KF, Yamamoto S, Zhu Y, Zheng H, Qi Y, Bellen HJ, Li H. Distinct systemic impacts of Aβ42 and Tau revealed by whole-organism snRNA-seq. Neuron. 2025 Jul 9;113(13):2065-2082.e8.
5. Zhao H, Liu Z, Chen H, Han M, Zhang M, Liu K, Jin H, Liu X, Shi M, Pu W, Werner M, Meister M, Kauschke SG, Sun R, Wang J, Shen R, Wang QD, Ma X, Tchorz JS, Zhou B. Identifying specific functional roles for senescence across cell types. Cell. 2024 Dec 12;187(25):7314-7334.e21.
6. Gautam V, Duari S, Solanki S, Gupta M, Mittal A, Arora S, Aggarwal A, Sharma AK, Tyagi S, Pankajbhai RK, Sharma A, Chauhan S, Satija S, Kumar S, Mohanty SK, Tayal J, Dixit NK, Sengupta D, Mehta A, Ahuja G. scCamAge: A context-aware prediction engine for cellular age, aging-associated bioactivities, and morphometrics. Cell Rep. 2025 Feb 25;44(2):115270.
7. Tao W, Yu Z, Han JJ. Single-cell senescence identification reveals senescence heterogeneity, trajectory, and modulators. Cell Metab. 2024 May 7;36(5):1126-1143.e5.

