为了解决化疗药物在临床使用上出现的副作用大、水溶性差、生物利用度低、血液清除快和多药耐药性等问题,基于纳米载体的药物递送系统得到了广泛的发展,不仅提高了载药量和血液循环时间,而且降低了负载药物的潜在系统毒性。到目前为止,传统的纳米载体通常由无机材料组成,如碳基纳米材料(CBNs)、磁性颗粒、二氧化硅、金基纳米材料和有机分子,如聚合物纳米粒子、脂质体、胶束等。其中,CBNs具有生物相容性好、低毒、高水溶性、能与多种分子结合等优点,已被广泛应用于药物递送、癌症诊断和治疗等领域,被认为是一种优良的纳米载体。据报道,负载DOX的CBNs可用于靶向肿瘤细胞核,但为了提高药物靶向率,通常需要修饰活性靶向配体,如抗体、叶酸和肽(RGD和核靶向肽)等,这些活性靶向配体在提高药物靶向性的同时也存在潜在的缺点,如抗体成本高、肿瘤穿透率低(因其体积大)、适体稳定性低(因血浆中的核酸酶)以及肽的循环半衰期低(因血浆中的肽酶)等问题。此外,修饰的靶向配体也使得合成过程繁琐且难以操作。
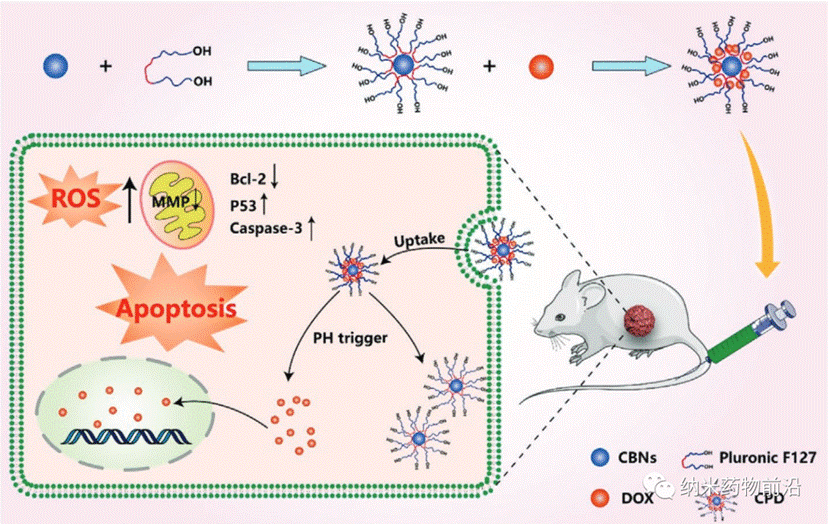
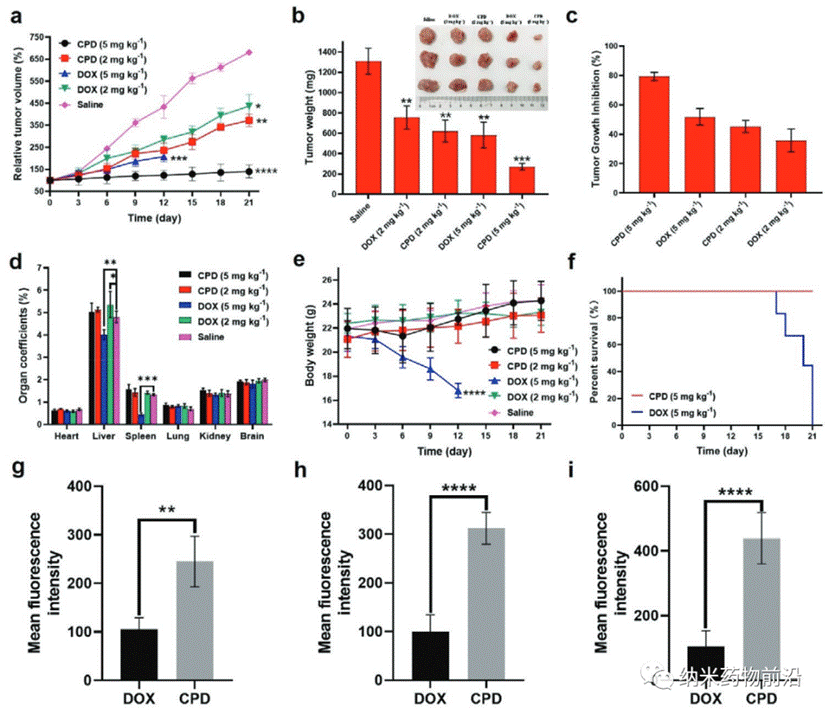
王艳丽教授团队在之前的工作中通过改进的碱基介导的水热分子融合合成了一种新型石墨烯基肿瘤细胞核靶向荧光纳米探针,该探针具有肿瘤细胞靶向性的特点,是一种CBN。该CBN具有体积小、无毒、生物相容性好、代谢速度快等优点。在此基础上,王艳丽教授用Pluronic F127包覆CBNs,并用其负载阿霉素(DOX)结合,成功制备了CBNs Pluronic F127-DOX(CPD)纳米药物递送系统。结果表明,CPD在肿瘤细胞核中的DOX靶向率高达36.78 %,在肿瘤组织中的ID/g百分比高达30.09 %,肿瘤生长抑制率高达79.42±2.83 %,大大降低了DOX的全身副作用。并验证了CPD通过增加细胞内活性氧(ROS)水平和降低线粒体膜电位(MMP)来调节Caspase-3、p53和Bcl-2基因的表达水平,从而促进肿瘤细胞凋亡,发挥其抗肿瘤作用,是一种很有前途的抗肿瘤药物。
全文链接:
https://pubmed.ncbi.nlm.nih.gov/34928029/

