传统的靶向递送系统主要是通过病理组织递送而实现细胞膜靶向并在细胞质中释放药物。递送系统可以通过EPR效应首先到达肿瘤组织,并穿过生物屏障,聚集在一个特定的细胞器中。然而,只有一小部分治疗药物可成功到达特异性细胞器靶点。因此,直接递送至亚细胞器是解决由于缺乏特异性而导致的高剂量要求和全身毒性的关键。与真核细胞的其他细胞器相比,具有双层膜的线粒体是细胞产生ATP的动力源和武器库。除了产生能量外,它们还参与多种生理活动,包括活性氧(ROS)产生、线粒体自噬、代谢、稳态和细胞凋亡。此外,线粒体也被证实易受高热的影响。这些特点使药物的线粒体特异性递送成为提高疗效的可行策略。
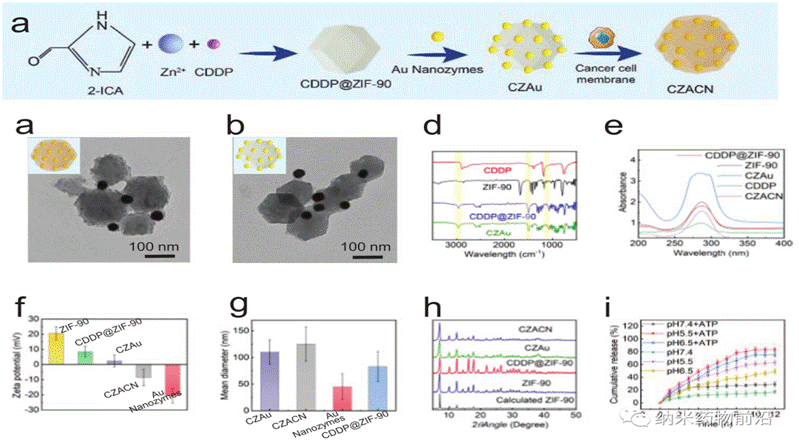
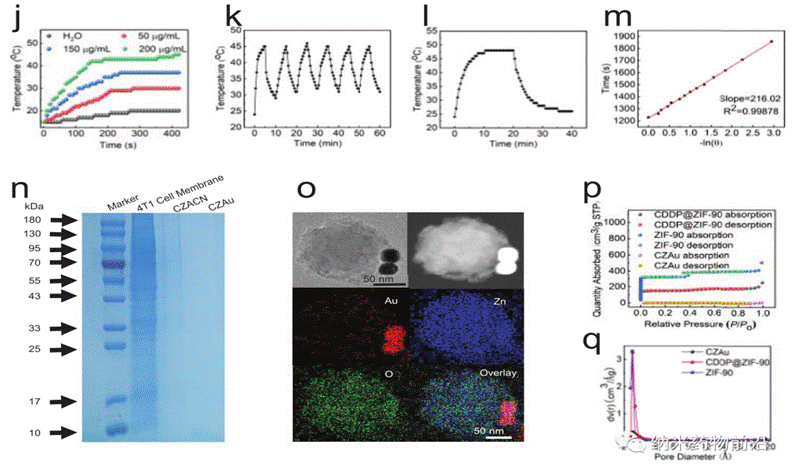
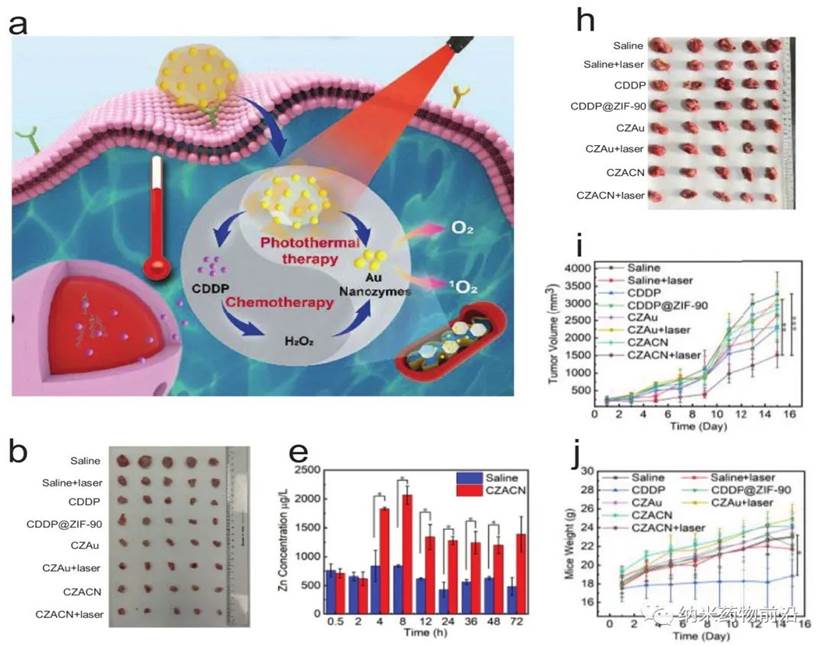
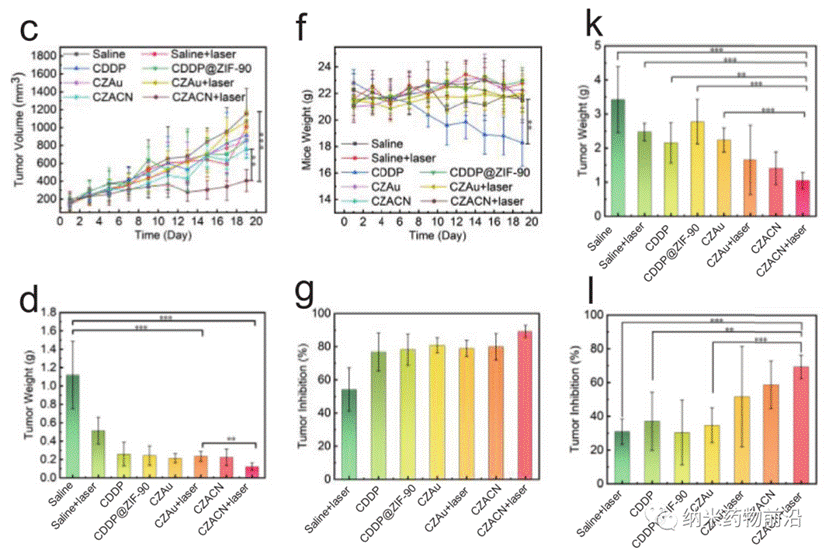
王艳丽教授团队设计了一种线粒体靶向纳米平台(CZACN)。它由用于线粒体特异性递送的ZIF-90、用于逃避免疫系统和靶向同源细胞的癌细胞膜、用于化疗的顺铂(CDDP)、用于氧自给和光热治疗的金纳米酶组成。ZIF-90从其他金属有机框架中产生,由于ATP与锌的竞争性配位导致其结构解体,因此ZIF-90对高ATP剂量环境具有敏感性。由于线粒体中的ATP含量几乎比细胞外环境高25倍,因此锌离子会从ZIF-90中解离出来,刺激ROS生成,最终导致细胞凋亡。ZIF-90可进一步被携带有癌细胞蛋白和抗原的癌细胞膜包裹,从而可以逃离免疫系统,靶向同源肿瘤细胞。CDDP是典型的铂基药物之一,与细胞核DNA相互作用形成Pt-DNA加合物,切断基因复制和转录,最终导致细胞凋亡和细胞死亡。它能激活NADPH氧化酶,产生O2•−,在癌细胞中产生H2O2。然而,由于CDDP可受肿瘤低氧微环境的影响,抑制Pt-DNA加合物的形成,因此可导致剂量限制性毒性。为了缓解肿瘤乏氧微环境,作者用ZIF-90包覆金纳米酶。ZIF-90具有模拟酶催化特性,催化性能和稳定性均优于天然过氧化氢酶。它们能在近红外光照射下催化过量的H2O2产生O2和单线态氧,缓解肿瘤乏氧,增强对癌细胞的毒性。此外,金纳米酶在激光(650-1100 nm)照射下具有良好的光热转换效果。实验表明,CZACNs具有氧自给、细胞器特异性释放和光热转换特性。此外,在近红外照射下,肿瘤生长抑制率可达到89.2±3.70 %,并降低了CDDP引起的剂量限制性毒性。近红外下52 ℃轻度热疗也可增强其通透性和流动性,最终增加其胞内蓄积,提高化疗-光热治疗的效果。
全文链接:
https://doi.org/10.1002/adfm.202108603

