01.李孔宁团队及合作者基于单细胞转录组揭示男女血管衰老差异影响阿尔茨海默症性别偏倚性
7月2日,生物医学信息与工程学院李孔宁教授课题组在《Aging Cell》在线发表题为“Activation of the hypoxia response in the aging cerebrovasculature protects males against cognitive impairment”的研究论文。

随着深度老龄化时代来临,阿尔茨海默症(AD)等衰老疾病高发已成为世界尤其中国面临的重大社会以及科学问题。流行病学数据充分表明女性更易高发AD,然而既往研究中关注的男女性激素差异等原因无法完全解释这种性别偏倚性,提示AD的致病机制远未明确。
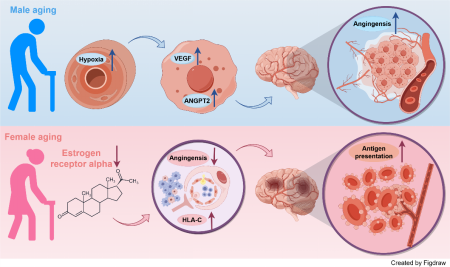
本研究另辟蹊径,受AD早期事件血脑屏障损伤启发,聚焦于同样具有男女差异并可能导致血脑屏障损伤的血管衰老过程。通过整合分析1,124例不同性别的AD及对照的脑血管单细胞转录组数据和传统bulk转录组数据,并结合AD小鼠模型功能实验,揭示了男性在正常血管衰老和AD疾病过程中均能够持续激活低氧应激反应及下游血管生成通路,而女性AD的血管系统则表现出免疫应答反应特异性增强。研究人员进一步发现女性衰老中血管系统功能下降的原因可能是雌激素受体与低氧诱导因子互作丢失,并基于此提出靶向雌激素转录因子CREB1的精准治疗方案。本研究充分发挥单细胞高分辨率精细解析、高通量数据特征挖掘以及功能实验验证的交互式优势,首次提出男女血管衰老差异可能是导致AD发病性别偏倚性的关键原因,对AD早期发病机制及潜在药物研发奠定理论基础,有望助力国家积极应对人口老龄化战略。
该成果以海南医科大学为第一通讯单位,生物医学信息与工程学院李孔宁教授、附属海南医院王波教授和香港中文大学吴邓博士为共同通讯作者,生物医学信息与工程学院硕士研究生李佩虎以及青年教师毕小慢博士、许达华博士为该文章共同第一作者。本研究得到国家自然科学基金、海南省重大科技计划、海南省自然科学基金等项目支持。
点击此处查看原文
02.李其富教授及合作者揭示转运蛋白ABCG2缓解癫痫发作的分子机制
7月4日,第一附属医院神经内科李其富、海南医科大学药学院王燕和国家儿童医学中心·复旦大学附属儿科医院临床药学部/复旦大学附属儿科医院昆山分院李智平团队合作在《Redox Biology》期刊上发表题为“ABCG2 shields against epilepsy, relieves oxidative stress and apoptosis via inhibiting the ISGylation of STAT1 and mTOR”的研究论文。

癫痫是常见的神经系统疾病,脑内神经元的异常放电引起肢体反复抽搐和意识丧失,给患者和社会带来沉重的负担。药物是治疗癫痫的主要方式,但仍有约30%患者对抗癫痫药物不敏感,机制不明,因此深入探析癫痫发生的机制具有重要意义。ATP结合转运体是一类依赖ATP水解将物质由细胞内转移至细胞外的跨膜蛋白,多项研究证实脑内分布的ABCG2与癫痫的发生发展相关,然而研究结果存在争议且机制尚不明确。
该研究通过体内外模型证实癫痫发作后诱导ABCG2应激性表达,通过抑制STAT1和mTOR的ISG化缓解氧化应激和凋亡,揭示ABCG2在癫痫发生中的保护作用,为药物治疗提供了潜在新靶点。研究验证了:1.癫痫动物模型和细胞模型中ABCG2表达升高。2.上调神经元和小胶质细胞ABCG2水平可以缓解Glu和KA介导的氧化应激和凋亡。3.CRISPR-CAS9敲除ABCG2缩短PTZ处理小鼠的存活时间,降低小鼠存活率,且与STAT1和mTOR相关。4.ABCG2与STAT1和mTOR直接结合,敲除ABCG2后促进STAT1和mTOR的ISG化,导致STAT1聚集并抑制mTOR的磷酸化作用。
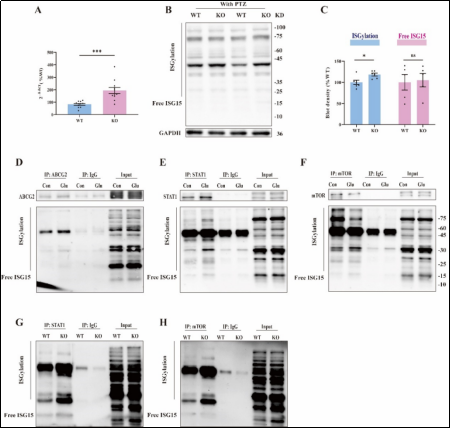
综上所述,该项研究初步证实癫痫发作后诱导ABCG2应激性表达可能通过STAT1和mTOR缓解氧化应激和凋亡,为癫痫发生发作干预提供了新思路。研究尚存在一些待解决的问题,比如ABCG2在不同类型癫痫患者脑内表达情况及多态性在癫痫发生发展的作用仍需进行更深入研究,以夯实其临床应用。
海南医科大学第一附属医院神经内科硕士研究生李昶和蔡毅主任医师为论文的共同第一作者,海南医科大学第一附属医院神经内科李其富教授、海南医科大学药学院王燕副研究员和复旦大学附属儿科医院临床药学部李智平教授为本文的通讯作者。研究受到国家自然科学基金、海南省重点研发项目、海南医科大学癫痫研究创新团队项目等项目的资助。
点击此处查看原文
03.夏乾峰科研团队揭示海南类鼻疽伯克霍尔德菌头孢他啶耐药分子机制
7月10日,热带医学院夏乾峰教授团队在《Drug Resistance Updates》在线发表题为“Point mutation P174L of the penA gene endowing ceftazidime resistance to Burkholderia pseudomallei in China”的研究论文。

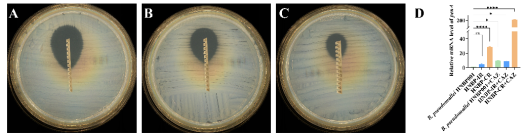
类鼻疽是由类鼻疽伯克霍尔德菌(以下简称Bp)感染导致的热带病,国内绝大多数病例集中于海南。临床资料显示海南Bp的耐药显著高于其他疫区,背后所涉及的分子机制和调控网络亟待探明。该课题组与三亚市人民医院检验科陈海主任合作,以临床Bp头孢他啶耐药株为实验对象,首先对其进行了全基因组测序,通过与野生型比对,发现该耐药株A型β内酰胺酶基因(penA)的539位胞嘧啶突变为胸腺嘧啶,从而导致氨基酸序列上的脯氨酸转变为亮氨酸。通过对耐药株中的penA进行敲除,或将含点突变的penA引入野生型Bp,证明该点突变可导致菌株的头孢他啶耐药能力上升,推测是该突变导致了PenA蛋白的保守区产生了更加适合水解头孢他啶的构象改变。但同时注意到单一的penA点突变无法让菌株达到临床耐药株相一致的头孢他啶耐药能力,为此还进行相关基因的转录分析,发现耐药株中还存在penA的高表达,并在头孢他啶的刺激下,penA的转录水平会进一步提高。该研究合理推测海南Bp的耐药率异常可能是头孢他啶作用下,penA的高表达导致了少部分菌株转化为耐受或持留菌得以存活,一旦penA又出现特殊的点突变(如上述的539位胞嘧啶突变为胸腺嘧啶),最终Bp会在治疗过程中表现出头孢他啶耐药。
该成果以海南医科大学为唯一通讯单位,热带医学院田申老师、吴兴勇硕士、刘琳老师、厉安洋硕士为论文共同第一作者,夏乾峰教授为通讯作者。本研究受到国家自然科学基金、海南省重点研发计划等项目资助。
点击此处查看原文
04.唐敏慧及合作者发现嗜碱性粒细胞和嗜酸性粒细胞上高表达的Gal-9与慢性自发性荨麻疹的疾病高活动性、特定表型标志物以及对奥马珠单抗治疗的反应有关
7月18日,第一附属医院皮肤科唐敏慧医师与合作者在《Allergy》发表题为“In chronic spontaneous urticaria, increased Galectin-9 expression on basophils and eosinophils is linked to high disease activity, endotype-specific markers, and response to omalizumab treatment”的研究成果。

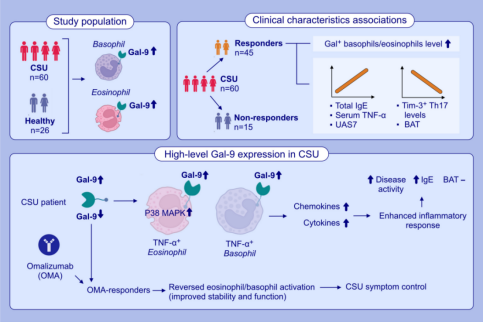
半乳糖凝集素-9(Gal-9)与过敏性和自身免疫性疾病相关,但其在慢性自发性荨麻疹(CSU)中的作用和相关性尚不明确。该研究评估了60名CSU患者和26名健康对照组,结果发现CSU患者的血液中Gal-9+嗜酸性粒细胞和嗜碱性粒细胞比例显著增多,并且存在大量病变的Gal-9+细胞。同时高比例Gal-9+嗜酸性粒细胞和嗜碱性粒细胞的患者表现出更高的疾病活动度和IgE水平,并且对奥马珠单抗治疗反应良好。进一步机制研究表明Gal-9+嗜酸性粒细胞/嗜碱性粒细胞与TIM-3+ TH17细胞呈负相关。这一发现为CSU的病理机制和个性化治疗提供了新的见解。
苏州大学附属第二医院季江主任、海南医科大学第一附属医院唐敏慧医师为该文章共同第一作者,苏州大学附属第一医院焦晴晴副研究员、德国Charité医学院Marcus Maurer教授为共同通讯。本研究得到国家自然科学基金项目支持。
点击此处查看原文
05.陈国强院士团队等发现T细胞在小肠和骨髓间迁徙环路调控抗白血病免疫新机制
7月22日,医学科学院陈国强院士和上海交通大学医学院附属上海儿童医学中心、国家儿童医学中心(上海)段才闻研究员、石蓉懿博士等合作在《Nature Cell Biology》发表题为“Trafficking circuit of CD8+ T cells between intestine and bone marrow governs antitumor immunity”(CD8+T细胞通过骨髓-肠道迁徙环路调控抗肿瘤免疫)的研究成果。
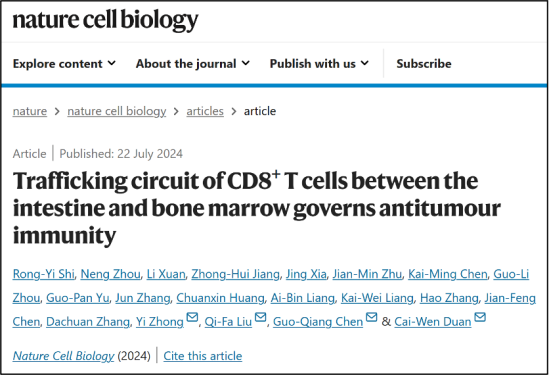
该研究利用多种白血病模型,发现白血病高度浸润后,骨髓中CD8+ 中枢记忆T细胞(Central memory T cell,Tcm)在转录因子BACH2调控下转变为新的细胞群,继而发生迁徙,该群细胞因此被命名为器官间迁徙CD8+ T细胞(Inter-organ migratory T cell,Tim);Tim细胞通过整合素β7(ITGB7)与粘膜地址素细胞粘附分子1(MAdCAM-1)的互作粘附于肠道并驻留。免疫原性化疗后,Tim细胞离开肠道,并依赖整合素α4(ITGA4)与血管细胞粘附分子1(VCAM-1)的结合回归骨髓。该迁徙环路的缺失显著减弱免疫原性化疗效果;阻断CXCR3可增强Tim细胞迁徙到肠道,从而更好地发挥抗肿瘤免疫作用。
综上所述,该研究发现了一群CD8+ T细胞亚群(Tim细胞)在组织间迁徙并响应机体肿瘤进展及免疫原性化疗。Tim细胞具有干性和表型可塑性,通过调节趋化因子受体和整合素在组织间迁徙并发挥重要的抗肿瘤免疫作用;该研究率先发现肠道作为CD8+ T细胞储存库,参与机体抗肿瘤免疫治疗网络的新机制。
国家儿童医学中心(上海)/上海交通大学医学院附属上海儿童医学中心石蓉懿博士后,周能博士和南方医科大学附属南方医院宣丽主任和江中慧为本论文共同第一作者,国家儿童医学中心(上海)/上海交通大学医学院附属上海儿童医学中心段才闻研究员,海南医科大学陈国强院士,南方医科大学附属南方医院刘启发主任,上海交通大学医学院附属仁济医院/上海市免疫治疗创新研究院钟怡研究员为本论文共同通讯作者。该研究得到国家重点研发计划和国家自然科学基金委等项目资助。
点击此处查看原文
06.陈国强院士团队报道PTEN作为细胞因子,通过结合在巨噬细胞特异表达的PLXDC2受体,驱动抗肿瘤免疫
8月27日,医学科学院陈国强院士与上海交通大学医学院肿瘤系统医学全国重点实验室沈少明研究员合作在国际顶尖学术刊物《Cell》子刊——《Developmental Cell》发表题为“Secreted PTEN binds PLXDC2 on macrophages to drive antitumor immunity and tumor suppression”的研究成果。

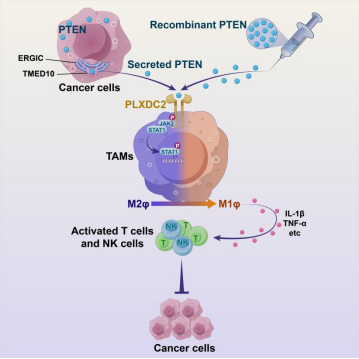
该研究揭示了PTEN可通过非经典蛋白分泌通路分泌到细胞外,并通过重编程肿瘤微环境中的巨噬细胞,实现抗肿瘤免疫的激活与肿瘤抑制。评审人高度评价该成果,指出该项研究“在揭示PTEN在动态肿瘤微环境中的复杂作用方面迈出了重要的一步,特别是它在癌症免疫治疗的应用。值得注意的是,这项研究揭示了PTEN和PLXDC2之间的一种全新的相互作用,阐明了以前未被挖掘的肿瘤内免疫调节机制。此外,该研究还显示PTEN能够加强抗PD -1治疗效应,强调了其临床应用前景。
为了了解PTEN导致巨噬细胞极化的分子机制,团队从包含1920个跨膜蛋白文库中,筛选到一个在巨噬细胞表面特异性表达的候选基因PLXDC2。进一步的系列体外实验和骨髓特异性的Plxdc2缺失小鼠证实PLXDC2属于PTEN受体。细胞外PTEN通过结合巨噬细胞表面的PLXDC2,激活JAK2-STAT1信号通路,进而介导巨噬细胞的抗肿瘤免疫并抑制肿瘤生长。M2样TAMs已被证明可以对各种治疗药物产生治疗耐药性,包括阻断PD-1的免疫治疗。为此,他们发现PTEN或PD-1抗体单药治疗均可减少多种肿瘤的大小,而联合PTEN/抗PD-1治疗效果最为显著。值得注意的是,PD-1阻断并不影响TIFs、淋巴结或血液中的细胞外PTEN的水平,但PTEN治疗提高了体内抗PD-1治疗的疗效。
综上所述,该研究发现PTEN发挥细胞因子样作用。它通过非经典分泌通路分泌至细胞外,通过与肿瘤免疫微环境中的巨噬细胞表面PLXDC2结合,经PTEN-PLXDC2-JAK2-STAT1轴线重编程肿瘤免疫微环境,抑制肿瘤进展。该研究在揭示了PTEN影响肿瘤免疫微环境的新机制的同时,为靶向PTEN的肿瘤治疗提供了重要理论基础。
上海交通大学医学院附属仁济医院博士后张铖,博士研究生马鸿明、沈嘉明和助理研究员武帅为该研究论文共同第一作者,陈国强院士和上海交通大学医学院附属仁济医院衰老与组织修复研究院沈少明研究员为共同通讯作者。该工作得到国家自然科学基金和国家重大研究计划的支持。
点击此处查看原文