近日,我校陈国强教授团队在国际权威学术刊物《Nature Communications》报道了题为“CDK9 recruits HUWE1 to degrade RARα and offers therapeutic opportunities for cutaneous T-cell lymphoma”(CDK9调控RARα蛋白降解并开发T细胞淋巴瘤靶向治疗新策略)的研究成果。

该研究发现,细胞周期蛋白依赖性激酶9(CDK9)是T细胞淋巴瘤(TCL)生长的驱动因素。抑制激酶活性、敲除或利用蛋白水解靶向嵌合体(PROTAC)降解CDK9蛋白,均可显著降低体外和小鼠模型中TCL细胞的生长。联合上海科技大学研究团队,研究人员合成、优化并筛选出在纳摩尔浓度靶向降解CDK9蛋白并杀伤TCL肿瘤细胞的GT-02897先导化合物。GT-02897与全反式维甲酸(ATRA)联合用药,可在体外和异种移植模型中协同抑制肿瘤生长,为彻底清除TCL提供了一种具有良好临床转化前景的治疗策略。
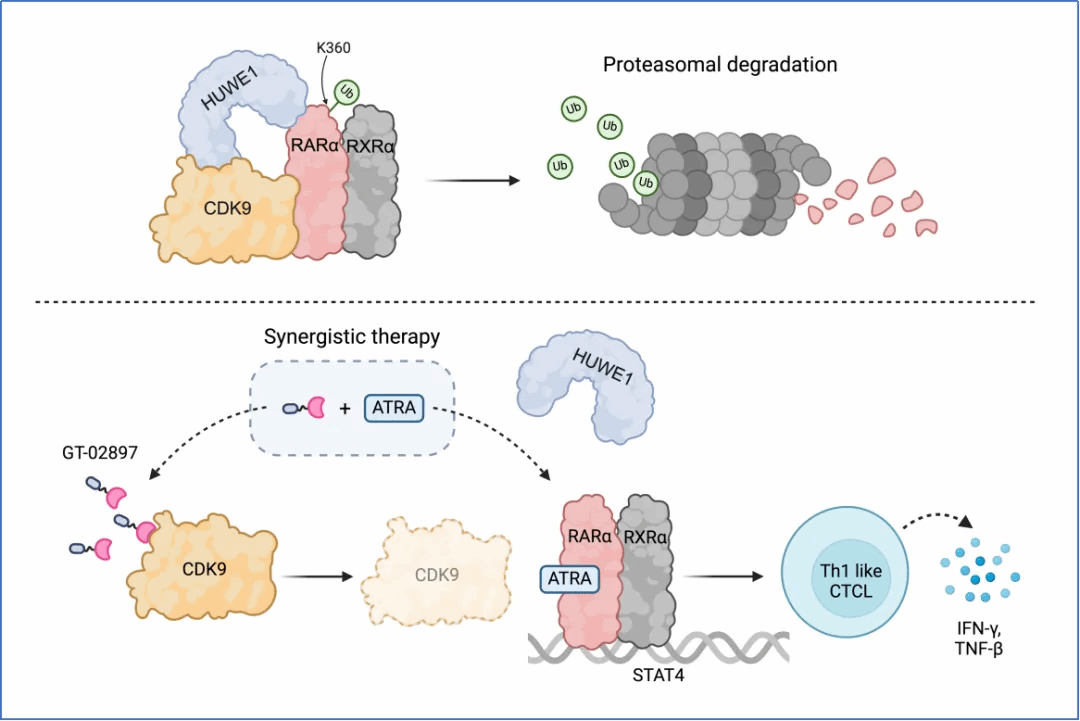
T细胞淋巴瘤(TCL)是以T淋巴细胞克隆性增殖为特征的一类恶性肿瘤。生物学行为和临床表现呈现高度侵袭性和异质性,缺乏高效、特异的治疗手段。研究团队首选利用小分子化合物库筛选出TCL细胞对CDK9抑制剂高度敏感。进一步,针对CDK9驱动TCL发生发展的机制,团队通过深入细致的研究揭示了CDK9激酶活性以外的新功能,即通过招募E3泛素连接酶HUWE1增强维甲酸受体RARα蛋白K360位点泛素化修饰水平及蛋白酶体途径降解。相应地, 降解CDK9蛋白则能提高RARα蛋白水平,从而赋予肿瘤细胞对RARα配体ATRA的敏感性。尤其重要的是,研究人员发现ATRA的治疗效果并非来源于对肿瘤的杀伤,而是诱导肿瘤T细胞定向分化为成熟CD4+CD25+Foxp3+的T-reg。基于这一新机制,团队开发了靶向降解CDK9联合ATRA的序贯治疗方案,在临床前模型中取得良好疗效。因此,该研究不仅为开发靶向CDK9的治疗策略提供更全面的理论依据,还将拓展诱导分化治疗的效应谱,具有重要的临床转化前景。
陈国强教授的博士生罗晨晖,上海交通大学医学院附属新华医院博士生胡丽红、刘洁洋,海南医科大学(海南省医学科学院)夏立副教授为该论文共同第一作者,海南医科大学(海南省医学科学院)陈国强教授、上海交通大学医学院附属新华医院卢莹研究员、上海科技大学杨小宝研究员和大连医科大学张学红研究员为共同通讯作者。该工作得到国家自然科学基金面上和重大研究计划的支持。