Controllable Regulation of Ag2S Quantum-Dot-Mediated Protein Nanoassemblies for Imaging-Guided Synergistic PDT/PTT/Chemotherapy against Hypoxic Tumor
Mengjie He【何梦洁】, Ziyi Cheng【程子译】, Zhenkai Wang【王振凯】, Min Li【李敏】, Huixian Liang【梁慧娴】, Heng Liu【刘恒】, Lijuan Yu【于丽娟】, Linlu Zhao【赵琳璐】, Fabiao Yu【于法标】
First published: 12 June 2023 https://doi.org/10.1002/adhm.202300752

Abstract
The combination of phototherapy and chemotherapy holds great potential for cancer treatment, while hypoxia in tumor as well as unexpected drug release largely restricts anticancer therapy. Inspired by the natural intelligence, herein, for the first time, a “bottom-up” protein self-assembly strategy mediated by near-infrared (NIR) quantum dots (QDs) with multicharged electrostatic interactions is presented to develop a tumor microenvironment (TME)-responsive theranostic nanoplatform for imaging-guided synergistic photodynamic therapy (PDT)/photothermal therapy (PTT)/chemotherapy. Catalase (CAT) possesses diverse surface charge distribution under different pH conditions. After modification by chlorin e6 (Ce6), the formulated CAT–Ce6 with patchy negative charges can be assembled with NIR Ag2S QDs by regulating their electrostatic interactions, allowing for effective incorporation of specific anticancer drug oxaliplatin (Oxa). Such Ag2S@CAT–Ce6@Oxa nanosystems are able to visualize nanoparticle (NP) accumulation to guide subsequent phototherapy, together with significant alleviation of tumor hypoxia to further enhance PDT. Moreover, the acidic TME triggers controllable disassembly through weakening the CAT surface charge to disrupt electrostatic interactions, allowing for sustained drug release. Both in vitro and in vivo results demonstrate remarkable inhibition of colorectal tumor growth with a synergistic effect. Overall, this multicharged electrostatic protein self-assembly strategy provides a versatile platform for realizing TME-specific theranostics with high efficiency and safety, promising for clinical translation.
结直肠癌(Colorectal cancer ,CRC)在发病率方面排名第三,但在死亡率方面排名第二,已经成为全世界的主要疾病负担之一。传统的CRC治疗方法,如手术和化疗,对身体造成过度损害或不可避免的副作用,当CRC转移到其他器官时,五年的生存率只有12%。最近,光疗包括光动力疗法 (Photodynamic therapy, PDT)和光热疗法(Photothermal therapy,PTT)与化疗的结合在癌症治疗方面有着巨大的潜力,然而肿瘤中的缺氧以及药物的意外释放,光疗的最佳时间窗口都在很大程度上限制了光疗协同化疗的抗癌疗效。
“自下而上”的自组装纳米技术的发展提供了一种有效的手段,将多个组分组织到整个纳米系统中,以建立高度有序的结构。与传统的封装型纳米载体相比,功能基团的直接自组装可以有效减少非功能分子的引入,进一步提高生物安全性增加临床转化的潜力。分子自组装中静电相互作用因其出色的远程动态可逆特性而被广泛运用。然而,单电荷静电组合通常是脆弱和不稳定的,特别是在复杂的体内条件下。相比之下,多电荷驱动的静电组装不仅保留了超分子组装的动态可控性,而且还保持了相当的稳定性,适合于生物医学应用。特别是,特定的TME(较低的pH值)和正常生理环境之间的差异为实现生物大分子如蛋白质的可控调节提供了机会,这主要是由蛋白质表面电荷在不同pH值条件下的变化引起的。同时,静电相互作用的可逆性可能会导致组装体对特定刺激(如酸性TME)的解离,这可能有助于实现药物的可控释放。目前,大多数关于CAT蛋白的研究只关注其催化产氧能力上,而对CAT表面电荷与生理和病理微环境之间相关性的调查却很少报道,这对静电组装和调节具有重要意义。另一方面,荧光QDs由于其配体可调节的特性,能够产生多电荷效应,从而使其成为驱动蛋白质静电组装的有前途的底物。因此,迫切需要开发基于多电荷静电相互作用的TME响应性蛋白纳米组合体,以实现有效的成像引导的联合治疗抑制肿瘤。
为了解决上述问题,海南医学院海南省生物材料与医疗器械工程研究中心于法标教授/赵琳璐副教授团队联合海南医学院附属肿瘤医院于丽娟教授团队开发了一种基于多电荷静电自组装策略的智能近红外QDs介导的蛋白质纳米系统(Ag2S@CAT-Ce6@Oxa),通过多价静电相互作用将具有荧光成像兼具良好光热效应的硫化银量子点(Ag2S QDs),光敏剂二氢卟吩(Ce6),催化产氧剂过氧化氢酶(CAT),结肠癌一线化疗药物奥沙利铂(Oxa)组装而成,能够特异性地响应肿瘤微环境(TME),能够很好的实现基于成像的协同光动力/热疗/化疗(图1)。该工作以“Controllable regulation of Ag2S quantum dots-mediated protein nanoassemblies for imaging-guided synergistic PDT/PTT/chemotherapy against hypoxic tumor”为题在线发表于杂志Advanced Healthcare Materials(DOI: 10.1002/adhm.202300752)
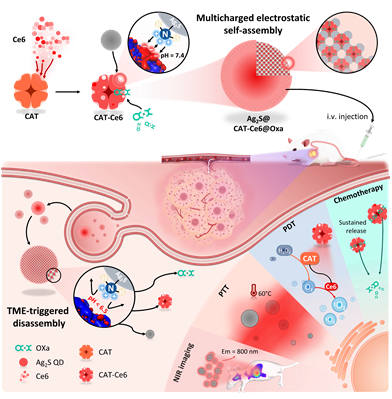
图1. Ag2S@CAT-Ce6@Oxa NPs的组装构建及体内TME解组装的成像引导的PDT/PTT协同化疗的示意图
【文章要点】
1、Ag2S@CAT-Ce6@Oxa NPs组装体的构建:首先合成Ag2S QDs功能基元,并对其表面进行多氨基修饰,光敏剂Ce6与CAT进行共价修饰获得表面具备多价负电荷基元CAT-Ce6,最后与Oxa不断优化条件共组装形成Ag2S@CAT-Ce6@Oxa NPs,离子浓度为(50 mM PBS,pH = 7.4)时,TEM及动态光散射表明组装体为80 nm ~ 100 nm,有良好的稳定性,并有效负载了结肠癌一线化疗药物Oxa。Oxa作为配体可以有效地结合到CAT上的VAL 55、SER 337、MET 339和ALA 345残基,分子对接模型为药物Oxa参与组装体稳定构建的结合模式提供了有力的解释。
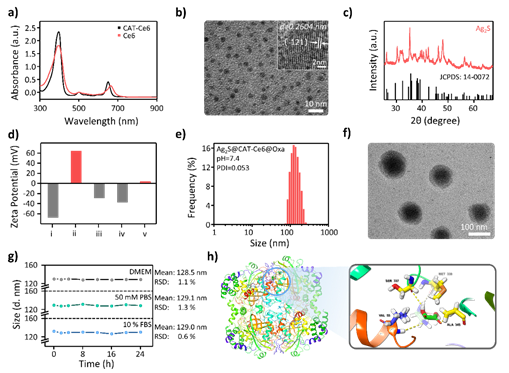
图2. Ag2S@CAT-Ce6@Oxa NPs的构建及表征
2、CAT等值面的计算结果发现中在模拟的生理条件下(pH = 7.4),蛋白质的等值面呈负电荷主导。当pH值下降到6.5甚至5.5时,蛋白质等表面的负电荷逐渐减弱,最终反转为正电荷。有鉴于此,我们可以提出,在酸性的TME中,组装系统中的静电作用被削弱,不足以维持静电组装,因此可能发生缓慢的拆分,导致药物的持续释放。Ag2S@CAT-Ce6@Oxa 纳米颗粒的 pH 值依赖性解聚通过DLS证实在模拟生理条件下(pH = 7.4),组装好的 Ag2S@CAT-Ce6@Oxa 纳米颗粒始终保持稳定,大小为 125 nm;模拟的酸性肿瘤微环境(pH = 6.5)下在30min内尺寸不断减小,最终维持在15 nm左右,并在随后的60 min中溶液尺寸依旧保持不变。TEM镜下的结果表明在模拟的酸性肿瘤微环境(pH = 6.5)下,Ag2S@CAT-Ce6@Oxa NPs 能够成功实现解组装并且光谱性质保持不变。
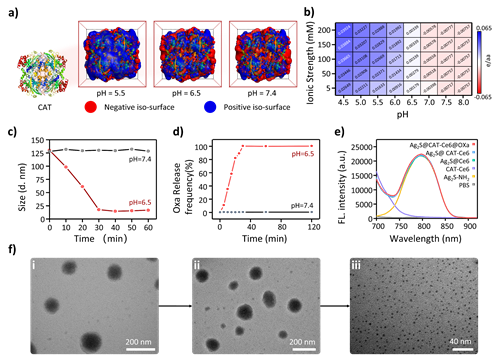
图3. Ag2S@CAT-Ce6@Oxa NPs解组装过程
3、Ag2S@CAT-Ce6@Oxa NPs 体外溶液的催化产氧的酶促反应实验表明,Ag2S@CAT-Ce6@Oxa纳米颗粒即使在较低的H2O2水平下也能保持较好的催化分解产O2的活性。在pH值低于6.5时仍然很强,这表明即使在酸性的TME中,Ag2S@CAT-Ce6@Oxa NPs仍然可以保持良好的催化能力。单线态氧(1O2)检测实验表明Ag2S@CAT-Ce6@Oxa NPs在缺氧环境下能够保持与常氧环境下相当的1O2生成。由于TME含有大量的内源性H2O2(50 μM ~ 100 µM),Ag2S@CAT-Ce6@Oxa NPs可以有效缓解缺氧导致的PDT效率降低。这为在缺氧的TME中实现更好的PDT疗效提供充分的验证。并且体外光热实验表明,Ag2S@CAT-Ce6@Oxa在激光照射下水溶液的温度可以在3 min内迅速达到约60 ℃,具有良好的光热性能。
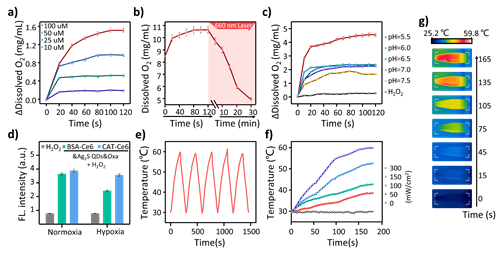
图4.体外评估PDT和PTT性能
4、组装体Ag2S@CAT-Ce6@Oxa细胞摄取实验表明,在与细胞孵育90 min后胞质内量子点的荧光较强,说明组装体可以被细胞有效内化,纳米材料的生物相容性对其在生物系统中的应用至关重要,使用CRC细胞(HT29)和CCK-8试剂盒评估了Ag2S QDs及Ag2S@CAT-Ce6@Oxa的细胞毒性实验结果表明Ag2S@CAT-Ce6@Oxa纳米颗粒仍具有低毒性和良好的生物相容性。总的来说,这些结果表明,所制备的Ag2S@CAT-Ce6@Oxa纳米颗粒具有良好的生物相容性和细胞摄取能力,使其成为进一步发展为治疗剂的有希望的候选者。
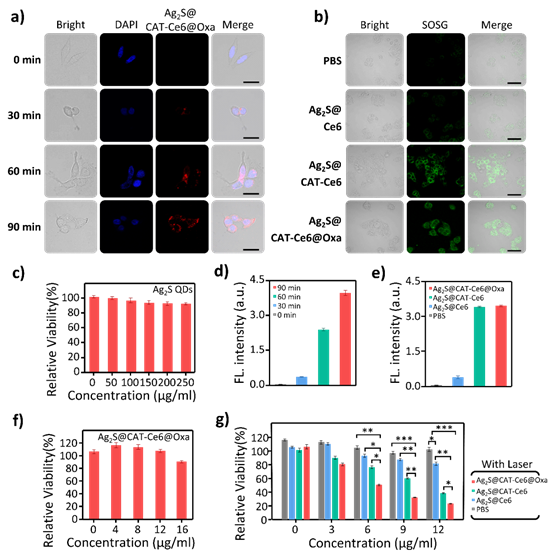
图5. Ag2S@CAT-Ce6@Oxa NPs的细胞摄取和生物相容性
5、体外杀伤肿瘤细胞的效果通过活死细胞染色实验结果表明,在常氧气条件下,与PBS组相比,Ag2S@Ce6、Ag2S@CAT-Ce6和Ag2S@CAT-Ce6@Oxa都有一定程度的红色和绿色荧光(红色代表活细胞,绿色代表死细胞),显示出良好的治疗效果。我们注意到,即使在缺氧条件下,Ag2S@CAT-Ce6@Oxa NPs仍能保持与常氧条件下相当的细胞杀伤能力。这表明在自组装系统的帮助下,细胞内的Ag2S@CAT-Ce6@Oxa NPs能够为缺氧条件提供氧气,从而增强了特定激光触发的PDT对CRC细胞的杀伤效果。同样在乏氧条件下不同处理组的HT29细胞的凋亡检测结果显示Ag2S@CAT-Ce6@Oxa组引起约60.79%的细胞凋亡,说明近红外诱导的Ag2S@CAT-Ce6@Oxa NPs的光疗作用主要通过细胞凋亡而不是坏死导致细胞死亡。肿瘤中HIF-1α的表达水平是由缺氧引起的,其蛋白印迹实验结果显示,与对照组相比,Ag2S@Ce6组的HIF-1α表达水平明显升高,而Ag2S@CAT-Ce6和Ag2S@CAT-Ce6@Oxa组的HIF-1α表达水平相对于Ag2S@Ce6则明显下降。这就说明Ag2S@CAT-Ce6@Oxa纳米探针可以有效缓解缺氧,提高PDT的疗效,从而达到对肿瘤细胞的良好杀伤效果。
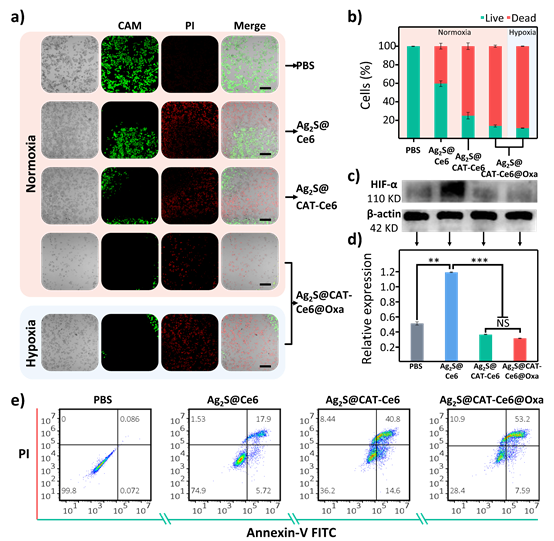
图6. 评估Ag2S@CAT-Ce6@Oxa NPs对HT29肿瘤细胞的体外协同治疗作用
6. Ag2S@CAT-Ce6@Oxa NPs 模型组中小鼠肿瘤部位的温度在最初3 min内迅速上升了29.6 ℃,然后维持在59.5 ℃,相比之下,PBS组的肿瘤温度只表现出轻微的波动,最终温度维持在31.4 ℃,这就说明组装体在体内表现优异的光热性能。活体荧光成像研究发现尾静脉给药后12 h,肿瘤部位荧光最强,确定了进行光疗的最佳光照时间点。在整个治疗的期间与对照组(Control)相比,Ag2S@Oxa、Ag2S@Ce6、Ag2S@CAT-Ce6和Ag2S@CAT-Ce6@Oxa NPs这四组的肿瘤都在一定程度上对肿瘤的生长都有所抑制,其中Ag2S@CAT-Ce6@Oxa NPs的肿瘤抑制效果最好,这个结果与荧光成像的结果保持一致。肿瘤生长热图的数据以及离体肿瘤大小也表明Ag2S@CAT-Ce6@Oxa NPs肿瘤生长被抑制得最多,这表明Ag2S@CAT-Ce6@Oxa纳米颗粒治疗组的抗肿瘤疗效最高。
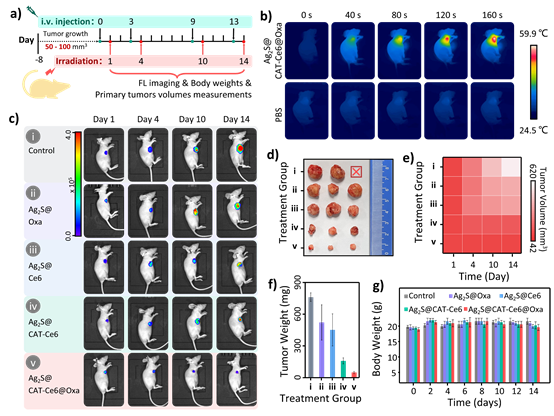
图7. 体内评估近红外成像引导下的协同治疗
【结论与展望】
综上所述,我们成功地设计了一个基于多电荷静电自组装策略的智能近红外QDs介导的蛋白质纳米系统(Ag2S@CAT-Ce6@Oxa),用于成像引导的结直肠癌协同PDT/PTT/化疗。该纳米系统的独特设计在于依赖于补氧蛋白CAT的表面电荷,该电荷由TME的pH特性调节,使抗癌药物Oxa的可控拆分和释放。CAT通过与Ce6形成酰胺键进行化学共轭作为PS与氨基化Ag2S QDs在生理条件下引发多电荷静电相互作用,使得形成分层有序的纳米结构,可以有效地装载和输送Oxa到肿瘤部位。该纳米系统在体外和体内显示出显著的疗效,实现了增强的PDT和PTT以及可控的化疗。此外,近红外荧光成像使纳米粒子积累得到可视化并指导进一步治疗。这项工作强调了多电荷静电自组装策略的潜力可作为一种简便有效的方法制备TME响应性功能蛋白组装的治疗性纳米系统,用于高效安全的癌症治疗,并为当前癌症治疗领域的挑战提供了潜在的解决方案。

