
Anti-cancer mechanism of iridium complexes
铱配合物抗癌机制
①A Photodynamic and Photochemotherapeutic Platinum-Iridium Charge-Transfer Conjugate for Anticancer Therapy
Huayun Shi+ ,* Oliver W. L. Carter+ , Fortuna Ponte, Cinzia Imberti, Miguel A. Gomez-Gonzalez, Fernando Cacho-Nerin, Paul D. Quinn, Julia E. Parker, Emilia Sicilia,* Huaiyi Huang,* and Peter J. Sadler*
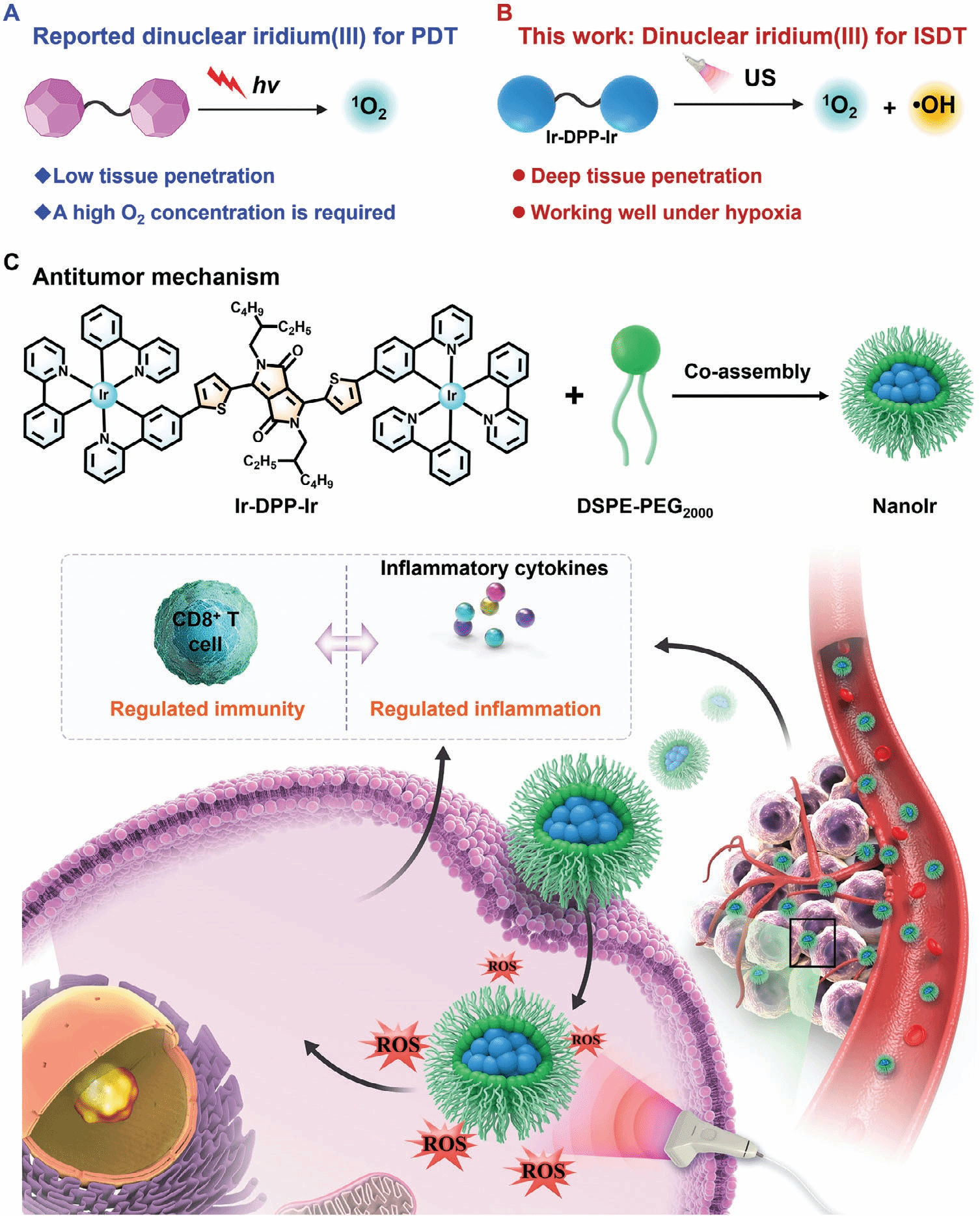
②Near Infrared-Fluorescent Dinuclear Iridium(III) Nanoparticles for Immunogenic Sonodynamic Therapy
Dongsheng Tang, Minhui Cui, Bin Wang, Chun Xu, Zheng Cao, Jin Guo, Haihua Xiao,* and Kun Shang*
DOI: 10.1002/adma.202406815
③High Photocytotoxicity Iridium(III) Complex Photosensitizer for Photodynamic Therapy Induces Antitumor Effect Through GPX4-Dependent Ferroptosis
JQing Zhang, Dezhi Chen, Xiaomeng Liu, Zhewen Deng, Jiaqi Li, Senqiang Zhu,* Bo Ma,* Rui Liu,* and Hongjun Zhu
DOI:10.1002/smll.202403165
研究背景:
近几十年来,恶性肿瘤已成为全球首要的死亡原因,也是提高人类健康和生活质量的主要障碍。传统治疗癌症方法包括放疗、手术或化疗,但肿瘤转移性强、易产生耐药性、复发频繁。光动力疗法 (PDT) 和光活化疗法 (PACT) 提供了两种重要的癌症治疗方式,即光疗法,其中利用光来激活前体药物,以提高对癌细胞与正常细胞的选择性。 PDT 药物依赖于氧气,可产生 1 O2 和其他活性氧 (ROS),并且已经在临床上使用。不依赖氧气的 PACT 药物在照射后通过化学变化形成活性物质,但仍在开发中。与基于有机分子的传统光疗法相比,光活性金属药物表现出多样化的结构、不同的氧化态、配位数和几何形状,这为避免耐药性提供了潜在的新作用机制。作为临床上应用最广泛的化疗抗癌药物,顺铂存在副作用、耐药性和肿瘤复发等问题,在此背景下,铱配合物因其可调的结构、理想的光物理性质、特别合适的能级和氧化还原电位而成为有前途的抗癌药物,同时含 Pt 异金属配合物也已被探索用于改善光细胞毒性、减轻 Pt 相关耐药性并提供治疗诊断特性。
研究内容:
基于铱配合物的小分子光敏剂的开发受到治疗效果与全身毒性之间不匹配以及对诱导细胞死亡的分子机制的不完整理解的限制,合成了一种具有高光毒性的小分子铱配合物IrC,表现出优异的抗肿瘤、缓解脾脏肿大和可忽略的副作用,IrC介导的活性氧的产生,加上对GPX 4和谷光氨肽的直接抑制,协同增加了细胞氧化应激和脂质过氧化水平。
设计并合成一个新型的异双核配合物Pt-Ir,具有很高的光细胞毒性,且光动力疗法(PDT)和光活化化学疗法(PACT)基序在一个分子中的组合为Pt-Ir提供了用于多模式光疗的新策略。
双核铱(III)配合物可作为光动力疗法(PDT)中的光敏剂。 在光激活下,它们可以产生单线态氧或其他可诱导癌细胞死亡的 ROS。它们在可见光至近红外区域的强吸收和三重激发态的高量子产率使它们成为 PDT 的有效药剂,与传统光敏剂相比,可能提供更高的治疗效果和最小的副作用。 与光动力疗法相比,声动力疗法 (SDT) 因其出色的组织穿透深度(>10 厘米)而引起了人们的极大兴趣,尤其是在肿瘤学领域。同时,SDT 已被证明可以诱导免疫原性细胞死亡 (ICD),从而增强肿瘤的免疫原性。这项工作提供了新的双核铱(III)配合物,可在超声照射下产生细胞毒性ROS,可广泛应用于癌症诊断和免疫原性声动力疗法ISDT。
要点:
由于目前光激活的双核铱(III)复合物的更广泛应用受到组织穿透无效和引导激活不良反馈的限制。本文首次报道了一种超声(US)触发的近红外荧光双核铱(III)纳米粒子 NanoIr,可以精确且时空地抑制肿瘤生长。
总结和展望:
本次汇报总结了目前Ir配合物与光动力治疗、光活化化学治疗以及声动力治疗结合的抗癌机制。铱配合物因其可调的结构、理想的光物理性质、特别合适的能级和氧化还原电位而成为有前途的抗癌药物,同时含 Pt 异金属配合物也已被探索用于改善光细胞毒性、减轻 Pt 相关耐药性并提供治疗诊断特性。

