(一)药物特点和国内上市情况
多黏菌素类是一类聚阳离子多肽。主要杀菌机制是药物所带的正电荷与细菌细胞膜上的负电荷脂多糖结合,进而破坏细胞膜发挥杀菌作用[1]。多黏菌素类抗菌谱窄,主要对肠杆菌目、气单胞菌属和一些非发酵菌(如铜绿假单胞菌、鲍曼不动杆菌等)具有体外活性,而革兰阳性菌、厌氧菌、支原体、衣原体、变形杆菌属、摩根菌属、沙雷菌属等对其天然耐药[2, 3]。获得性耐药机制主要包括染色体介导phoPQ、pmrAB、mgrB等突变和质粒介导的可移动黏菌素耐药基因mcr导致。
用于临床抗感染治疗的药物主要有多黏菌素B和多黏菌素E(即黏菌素)两类。注射用硫酸多黏菌素B、硫酸黏菌素分别于2017年9月和2018年3月在我国大陆上市。硫酸黏菌素与国外普遍使用的甲磺酸黏菌素不同,前者本身为活性成分,在体内直接起效,而后者需在体内转化为活性的黏菌素才起效,因此硫酸黏菌素与甲磺酸黏菌素的给药剂量不可等量换算。
(二)药敏试验方法
1.药敏试验面临的困境:多黏菌素类分子量大,在琼脂内不易扩散,2017年临床和实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)不再推荐错误率高的纸片扩散法、琼脂扩散法和浓度梯度扩散法(包括E试验)[4, 5]。进口自动化检测系统假敏感率高,因无法检测mcr阳性菌株而被美国食品及药品监督局(Food and Drug Administration,FDA)召回了相应板条;唯一国际批准和认可的方法微量肉汤稀释法(broth microdilution, BMD)因其手工操作复杂、耗时长,实验室很难常规开展。很多获批的国产药敏检测系统虽然含有多黏菌素类,但其和金标准BMD方法的一致性,特别是其对mcr阳性菌株的检测性能均未见相关文献报道。2020年,CLSI仅仅给出了多黏菌素类中介和耐药折点[6](表1),而无敏感折点,这更使实验室和临床陷入困境。
2.药敏试验指征:建议如下情况进行多黏菌素类的药敏试验:(1)在肠杆菌目、铜绿假单胞菌、鲍曼不动杆菌对碳青霉烯类耐药比例高的医疗机构,常规检测和报告该药的药敏结果。通常认为,碳青霉烯类药物耐药率达到或超过15%~20%时,宜开展多黏菌素类的药敏试验。(2)临床分离株确定为感染的病原菌,医生考虑用多黏菌素类治疗时,需补充测试并报告该药的药敏结果。(3)耐药监测、流行病学调查和科学研究需要时。
3.药敏试验方法的选择建议:(1)BMD是多黏菌素类药敏检测的金标准,有条件的实验室可以开展。(2)黏菌素肉汤纸片洗脱法(colistin broth disk elution, CBDE)和黏菌素琼脂试验(colistin agar test, CAT)用于肠杆菌目、铜绿假单胞菌对黏菌素的敏感性检测,不适用于鲍曼不动杆菌。(3)在体外试验中,黏菌素和多黏菌素B是等效药,前者可预测后者的结果,反之亦然。(4)不推荐琼脂稀释法、纸片扩散法和浓度梯度扩散法。(5)目前不推荐自动化或半自动化仪器检测多黏菌素类的耐药性。(6)曾经获批的商品化试剂,需要重新评价其对含mcr等耐药基因的临床株的检测能力。通过实验室的性能验证后,才可以用于临床。多黏菌素类体外药敏检测流程参考图1。
图1 多黏菌素类体外药敏检测流程图
4.推荐的药敏试验注意事项:不同方法的注意事项如下。
BMD法:多黏菌素黏度高,早期BMD需要添加表面活性剂聚山梨酯80,但这会导致药物MIC降低并漏检mcr阳性菌株[7, 8, 9],因此目前不推荐添加聚山梨酯80。
CBDE法:10 ml的阳离子调节MH肉汤(cation-adjusted Mueller-Hinton broth,CAMHB)管分别加入不同量的10 μg黏菌素纸片,使其浓度分别为0、1、2和4 mg/L。加入终浓度为7.5×105 CFU/ml的待测菌液,培养16~20 h读取结果。要求接种物必须为纯培养,注意检查生长对照管,有些铜绿假单胞菌可能只在近液面生长,读取完全抑制受试菌生长的最低浓度为MIC。
CAT法:制备含0、1、2和4 mg/L倍比稀释的黏菌素琼脂平板,每块平板最多可测10株菌。0.5麦氏浊度菌 1∶10稀释后取10 μl,用接种环划线于黏菌素琼脂平板,孵育16~20 h读取结果。读取时使用透射光检查黏菌素平板,出现菌落或者薄雾状菌膜为生长。目前还没有商品化的CAT平板。CAT法操作较CBDE复杂,适合样本量大的实验室。
5.其他药敏方法的适用性和分子检测技术:实验室若开展其他药敏试验方法(表2),首先应与参考方法(BMD)就以下指标进行比对评估:分类一致性(category agreement, CA)、基本一致性(essential agreement, EA)、假敏感(极重大错误,very major error, VME)以及假耐药(重大错误,major error, ME)等,以综合判读其可靠性。可接受的标准是:CA≥90%、EA≥90%(适用时)、VME≤3%以及ME≤3%[10]。
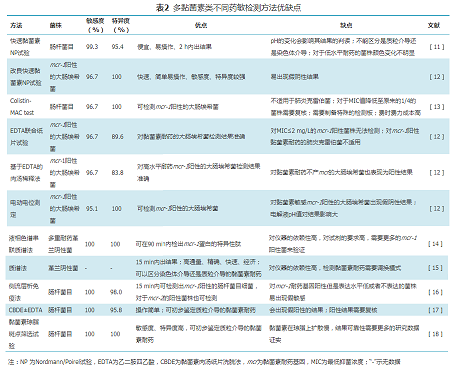
多黏菌素类耐药机制复杂多样,不同菌种耐药机制不同,分子检测不易常规开展。建议有条件的实验室,可以采用实验室自建方法(laboratory developed test, LDT)——多重PCR检测mcr-1到mcr-5基因[19]。通常,mcr基因阳性结果考虑耐药,而阴性结果不能排除耐药。建议结合表型检测结果进行解释。
6.药敏折点的选择:表1显示了CLSI和欧洲抗微生物药物敏感性委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)关于多黏菌素类药敏折点情况。由于国内用于治疗多重耐药菌和泛耐药菌感染的药物非常有限,考虑治疗用药的可及性和临床的需求,推荐暂时使用EUCAST 10.0 版的折点[20],其次可参考2019 CLSI文件推荐的流行病学界值(epidemiological cutoff value,ECV)[21],暂不使用2020年CLSI新版折点[6]。如使用,请在报告单备注该药仅有中介和耐药折点,而无敏感判断的折点。
各医疗机构药事委员会或抗菌药物管理委员会,可召集临床微生物学、临床医生(至少包括感染科、呼吸科、重症医学科、血液科等)、临床药师和感控同仁,对上述判定标准进行讨论和确认。
7.多黏菌素类的药敏结果报告:当体外试验结果中有其他多种药物敏感时,不报告多黏菌素类的药敏结果。如报告,建议报告其具体MIC值和结果解释(图2)。建议报告单备注:(1)黏菌素的MIC值可用于预测多黏菌素B的MIC值。(2)该药临床疗效有限,需关注肾毒性。(3)如需使用,应给予负荷剂量,并根据肾功能给予最大推荐剂量。(4)如可能,多黏菌素类应和其他活性药物联合使用。(5)折点不适用于多黏菌素类吸入疗法,尚未建立吸入剂型折点。给药剂量等见文献[22]。
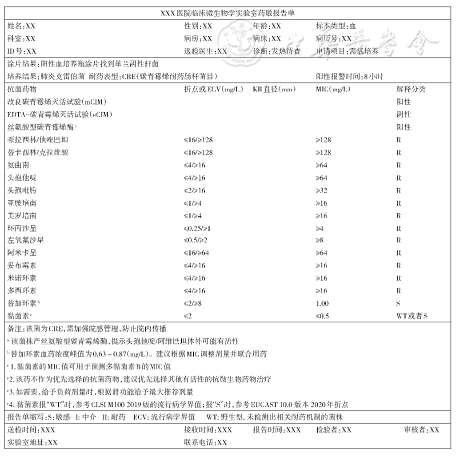
图2 药敏试验结果报告单示例

