动脉粥样硬化(AS)是一种临床疾病,由于脂肪物质、胆固醇、巨噬细胞、细胞废物、钙和其他物质的积累而导致动脉壁变厚,从小减少动脉血流量。动脉粥样硬化是心血管疾病的核心,导致心肌梗死、中风和周围血管疾病。这些疾病在全世界是主要的死亡原因,动脉粥样硬化机制尚不清楚。但是,各种细胞和动物模型已经显著地提高了我们对动脉粥样硬化相关机制的理解。本文主要介绍那些已被用于研究动脉粥样硬化的动物模型以及细胞模型。
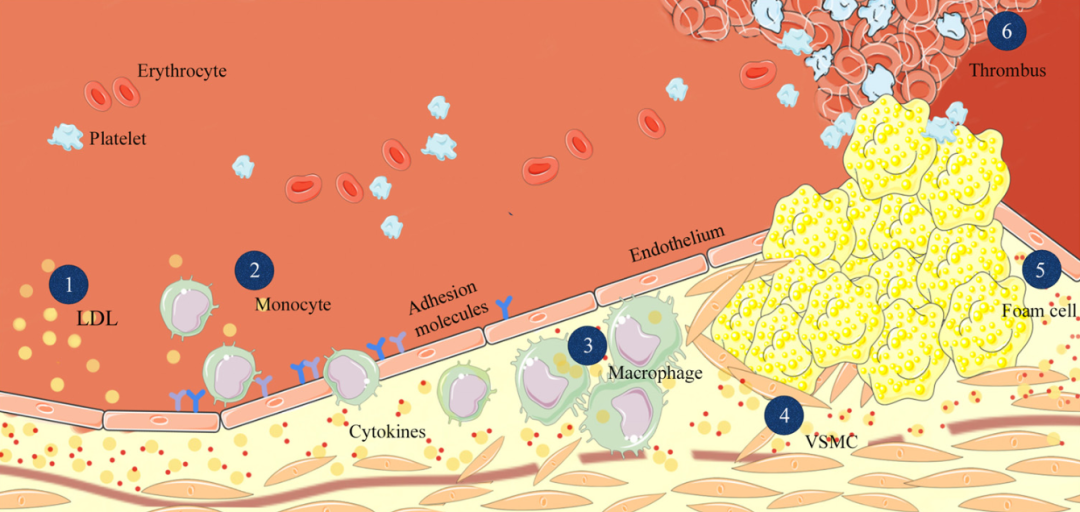
细胞模型对于研究疾病的特定分子机制至关重要。通常用于AS研究的细胞类型包括内皮细胞、巨噬细胞和平滑肌细胞。AS始于内皮功能障碍,这导致内皮细胞释放粘附因子和趋化因子,招募大噬菌体在内膜中积累。巨噬细胞诱导生长因子和趋化因子的释放,以促进平滑肌细胞的增殖和迁移。同时,巨噬细胞吞咽脂质会导致泡沫的形成。表1介绍了不同细胞类型常用原代细胞、细胞系和一些应用[1]。
细胞类型 | 常用原代细胞 | 常用细胞系 | 应用 |
内皮细胞 | 人脐静脉内皮细胞 人微血管内皮细胞 |
| 内皮细胞功能障碍 炎症反应 |
巨噬细胞 | 腹膜巨噬细胞 骨髓源性巨噬细胞 | THP1;RAW264.7;U937 J774a.1 | 吞噬、增殖、迁移、粘附、极化 |
平滑肌细胞 | 大鼠血管平滑肌细胞 小鼠血管平滑肌细胞 | A7r5; MOVAS‑1 | 钙化、表型转化、增殖、迁移 |
体外培养可用来构建泡沫细胞模型的细胞包括RAW264.7、THP1及U937等。这些细胞均为肿瘤细胞,本身具有传代稳定的特性,对培养基条件要求不高,易于培养,均适合用于构建泡沫细胞模型。泡沫细胞模型建立的造模方法多采用ox-LDL刺激。
方法:采用50 μg/mL ox-LDL刺激RAW264.7细胞48 h,油红O染色显示细胞体积增大,呈圆形、短梭形或不规则形,胞浆内大量红色或暗红色圆形脂滴,细胞泡沫化显著[2]。用作AS模型的动物须易于获得,能以合理的成本维护,容易处理并具有明确的遗传特征。目前,常用于建立AS模型的动物包括大鼠、小鼠、小型猪和家兔等,各有其优缺点。表2介绍了动脉粥样硬化常用动物模型的优点和局限性。表2 动脉粥样硬化常用动物模型的优点和局限性[3]
| 优势 | 局限性 |
小鼠 | 相对便宜;容易杂交;药物干预研究的成本较低 | 与人类斑块的差异:冠状动脉斑块形成减少;没有斑块内新生血管的形成和出血;罕见斑块破裂和血栓形成 |
大鼠 | 易于处理和饲养,一些遗传性高脂血症大鼠,过表达人类CETP的转基因大鼠产生动脉粥样硬化 | 对动脉粥样硬化发生高度抵抗,高HDL,无CETP |
兔 | 天然LDL受体缺陷品系,天然高甘油三酯血症品系,大小适宜,易于保存和处理,许多研究者知道,对膳食胆固醇的反应良好的,以及转基因的可用性 | 病变部位与人类不太相似,大多数循环胆固醇是高密度脂蛋白,诱导动脉粥样硬化需要极高血浆胆固醇,无晚期病变,肝脂肪酶缺乏,无自发性动脉粥样硬化 |
非人灵长类 | 与人类最接近;一些品系对饮食胆固醇反应较好;一些品系自发性早期动脉粥样硬化;家族性低密度脂蛋白受体缺乏;外科血管成形术反应良好 | 严重的慢性肾病;病变部位的变化;可用性有限;昂贵和伦理问题;监管严格 |
小型猪 | 体型保证了组织可用性和非侵入性检测;具备除HDL亚类外的人类样脂蛋白谱;正常饮食中度动脉粥样硬化敏感; | 斑块的发育主要在泡沫细胞阶段结束;由于斑块破裂而导致的血栓形成是极少的;相对昂贵,也更难处理 |
基因工程小鼠模型
尽管小鼠模型有其局限性,但其仍然是动脉粥样硬化模型的首选物种。基因操作的便利性允许转基因,基因敲除和敲入以及条件性敲除。小鼠最常用的两种动脉粥样硬化模型分别是ApoE-/-模型和LDLR-/-模型。优点:基因工程建模具有简单、方便、快速、高效的优点,可以快速有效地制备需要的转基因型小鼠。缺点:小鼠和人类之间的脂质代谢存在显著差异,与人类相比,正常小鼠缺乏胆固醇脂转移蛋白(CETP),血浆中的胆固醇水平通常较低,形成的AS病变也不具有厚的纤维帽。ApoE-/-模型:ApoE是血液中最重要的载脂蛋白,介导了血浆脂蛋白的运输与清除,当小鼠缺失ApoE时,其血液中总胆固醇(TC)、低密度脂蛋白(LDL)、极低密度脂蛋白(VLDL)含量都会增加,增加了小鼠AS的发生风险。apoE-/-模型的优点是,即使血浆胆固醇水平在300-500 mg/dL之间,复杂的血管病变也很容易发生[4]。在饲喂普通饲料时,在8至10周龄时出现泡沫细胞病变,15周后出现中间病变,包含梭形细胞(主要是SMC),20周后,纤维斑块明显包含SMC、细胞外基质和一个覆盖的纤维帽。饲喂高脂肪、高胆固醇的西方型日粮(WTD,通常为0.2%胆固醇,21%乳脂)可显著加速动脉粥样硬化的发生速度,导致血脂水平显著升高。LDLR-/-模型:LDLR是一种广泛存在于血浆中的TC运输蛋白,参与介导LDL和VLDL的清除,小鼠缺失LDLR会导致其体内中间密度脂蛋白(IDL)、LDL和乳糜微粒(CM)浓度提升,同时患上AS的风险也显著升高。使用普通饲料喂养LDLR-/-小鼠4个月后进行病理检测,发现纤维帽和纤维斑块形成。高脂饮食时,LDLR-/-小鼠会表现出更大且更晚期的AS斑块,高脂伴胆酸饮食的LDLR-/-小鼠大约6周后可于主动脉弓等处发现广泛AS斑块。
模型 | 优点 | 缺点 |
ApoE-/-小鼠 | 正常日粮下自发性高脂血症和病变形成 | apoE的多重功能; 高脂血症伴高密度脂蛋白升高;自发性斑块破裂,心肌梗死未见报道 |
LDLR-/-小鼠 | 与人类似的高脂血症 | 病变进展需要饲料调控;缺乏复杂病变的证据; |
dKO小鼠 | 自发性斑块破裂和心肌梗死 | 早产死亡 |
PCSK9-AAV小鼠 | 没有种系遗传操作 | 病变进展需要饲料调控;缺乏复杂病变的证据; |
高脂、高胆固醇饲料诱导法
方法:使用高脂、高胆固醇饲料(15%脂肪,1.25%胆固醇和0.5%胆酸)饲喂6-8周龄C57BL/6J小鼠,14周后出现高胆固醇血症(约200 mg/dL),形成散在脂肪条纹病变[5]。高脂、高胆固醇饲料饲喂ApoE-/-小鼠相结合可以缩短造模时间。优点:饲料诱导造模方法简单,成本低,可操作性强,适合大规模建立AS模型,成为了小鼠最常见的一种AS建模方法。缺点:斑块形成的时间不确定,部分小鼠建模可能时间过于漫长,超过20周才能完成AS建模。
动脉钳夹术法
手术动脉钳夹法的原理是机械压迫阻断动脉正常供血,导致局部血管缺血缺氧,颈动脉内膜损伤,引发炎性反应,进而促进AS的发生。方法:使用血管钳夹住大鼠一侧颈动脉20 min,手术后以高脂饲料喂养,6周时大鼠动脉内膜便有明显增厚,大量泡沫细胞聚集的现象,10周时形成典型纤维帽,成功建立大鼠AS模型。优点:能够人为控制AS的形成或病变部位,比较有利于对AS的并发症脑卒中的研究。缺点:对实验人员的操作技术要求较高,且手术中的不稳定因素较多,在大鼠造模中的个体差异较大,不易形成稳定的AS病变和统一的AS模型。
球囊损伤术法
球囊损伤术是制备血管损伤后再狭窄模型的常见方法,此方法的主要操作是将一定直径大小的球囊放入动脉血管后充盈球囊,通过反复拖拉充盈后的球囊造成动脉血管内皮细胞损伤,造成内皮细胞的即刻脱落,弹力板及中膜严重损伤,引起局部血管狭窄。方法:将充满生理盐水的塑料球囊导管自大鼠颈外动脉进入胸主动脉,向外拉至颈外动脉再进入胸主动脉,反复3次,再喂以高脂、高胆固醇饮食8周后,可以出现明显动脉粥样硬化病变。注意事项:注意选择内径大小适宜的球囊,牵拉过程中速度、力度的把握以及对球囊扩张压力的控制。在球囊损伤手术之后的3-5 d需密切观察动物状态,还需腹腔注射青霉素钠防止术后感染,造成不必要的死亡与损伤。
免疫损伤法
免疫损伤对于AS的影响较大,研究人员可将免疫损伤为切入点制作动物模型。常用的免疫刺激剂有肺炎支原体、幽门螺杆菌、EB病毒、巨细胞病毒、脂多糖等,它们可以诱导免疫反应的发生、发展。目前许多研究已经建立了尽可能类似于人的AS动物模型,然而当前每种动物模型都有其优点和局限性,需要根据实验需求和条件选择合适的模型。上述方法中的单一造模方式周期较长,因此,可以使用多种方法相结合的AS造模方法,可迅速提高造模的速度。[1] Zhang Y, Fatima M, Hou S, Bai L, Zhao S, Liu E. Research methods for animal models of atherosclerosis (Review). Molecular medicine reports, 2021, 24(6).[2] Liu Z, Zhu H, Dai X, Wang C, Ding Y, Song P, et al. Macrophage Liver Kinase B1 Inhibits Foam Cell Formation and Atherosclerosis. Circulation research, 2017, 121(9): 1047-1057.[3] Xiangdong L, Yuanwu L, Hua Z, Liming R, Qiuyan L, Ning L. Animal models for the atherosclerosis research: a review. Protein & cell, 2011, 2(3): 189-201.[4] Zhao Y, Qu H, Wang Y, Xiao W, Zhang Y, Shi D. Small rodent models of atherosclerosis. Biomedicine & pharmacotherapy, 2020, 129: 110426.[5] Getz GS, Reardon CA. Animal models of atherosclerosis. Arteriosclerosis, thrombosis, and vascular biology, 2012, 32(5): 1104-1115.

