共聚焦显微镜比传统光学显微镜具有几个优点,包括景深浅、消除离焦眩光以及从厚标本中收集连续光学切片的能力。在生物医学科学中,共聚焦显微镜的一个主要应用涉及对通常用一个或多个荧光探针标记的固定或活细胞和组织进行成像。
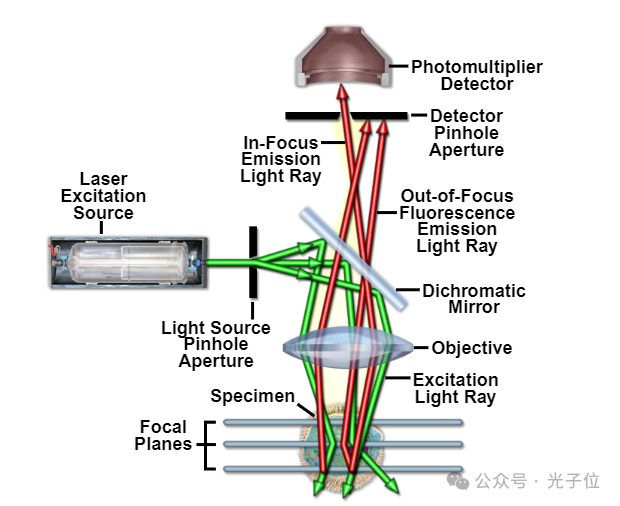
图1-共聚焦显微镜中的主要光路
当使用传统的广角光学显微镜对荧光标本进行成像时,远离感兴趣区域的标本发出的二次荧光通常会干扰聚焦特征的分辨率。这种情况对于厚度大于约2微米的试样尤其成问题。共聚焦成像方法在轴向和横向分辨率方面都有微小的提高,但正是该仪器能够从图像中排除在厚荧光标记标本中发生的“失焦”耀斑,这导致了该技术最近的普及。大多数当前的共聚焦显微镜相对易于操作,并已成为许多多用户成像设施的基本仪器的一部分。由于激光扫描共聚焦显微镜(LSCM)的分辨率略优于传统的广角光学显微镜,但仍远低于透射电子显微镜,因此它在某些方面弥合了两种更常用技术之间的差距。图1显示了基本共聚焦显微镜配置中的主要光路。
在传统的广角显微镜中,整个标本都暴露在汞或氙源的光线中,图像可以直接用眼睛观察,也可以直接投影到图像捕获设备或摄影胶片上。相比之下,共聚焦显微镜中的成像方法根本不同。照明是通过扫描一个或多个聚焦光束来实现的,通常来自激光,穿过试样(图2)。以这种方式扫描样本产生的图像称为光学切片。该术语是指仪器使用聚焦光而不是物理手段来分割样本,从而收集图像的非侵入性方法。
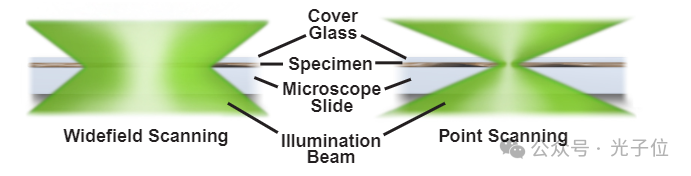
图2-样品的宽视场与点扫描
共聚焦方法促进了活标本更有用的成像,实现了三维(z系列)数据的自动收集,并改进了使用多重标记获得的标本图像。图3显示了常规落射荧光图像与用碘化丙啶染色的整个蝴蝶蛹翼上皮相似区域的共聚焦图像的比较。由于消除了离焦荧光耀斑,LSCM图像中核的分辨率有了显著提高。
激光扫描共聚焦显微镜(LSCM)是目前生物医学研究应用中使用最广泛的共聚焦变体。在本介绍中,重点放在LSCM上,因为它是新手用户最有可能遇到的设计。这些仪器的其他替代设计在生物成像领域的特定细分市场中受到青睐。大多数标本制备方案只需稍作修改,即可用于任何共聚焦仪器变体,以及用于生产光学切片的其他方法,如解卷积技术和多光子成像。
共聚焦显微镜的发展
共聚焦显微镜的发明通常归功于马文·明斯基,他在1955年制造了一台工作显微镜。共聚焦方法的发展在很大程度上是由对活组织(体内)中发生的生物事件进行成像的愿望驱动的,Minsky的目标是在活体大脑的未染色制备中对神经网络进行成像。明斯基提出的共聚焦成像原理于1957年获得专利,适用于所有现代共聚焦显微镜。图1说明了应用于落射荧光显微镜的共聚焦原理,该原理已成为用于荧光成像的大多数现代共聚焦系统的基本配置。明斯基的原始配置使用放置在锆弧源前的针孔作为点光源。

图3-蝴蝶翼上皮
光点被物镜聚焦在试样中所需的焦平面上,穿过它的光被第二个物镜聚焦在与第一个针孔具有相同焦点的第二个针孔上(这两个针孔是共焦的)。任何穿过第二个针孔的光都会照射到低噪声光电倍增管上,该光电倍增管产生的信号与试样发出的光的亮度有关。第二个针孔阻止了来自试样焦平面上方或下方的光到达光电倍增管。在比焦平面厚的标本中,使用空间滤波来消除离焦光或光斑是共焦方法的关键。在明斯基的著作中,他还描述了一种反射光版本的显微镜,该显微镜使用了一个物镜和一个双色镜装置,这成为了目前使用的系统的基础。
为了使用共焦原理构建图像,必须以某种方式在样本上扫描聚焦的光点。在明斯基建造的原始仪器中,光束保持静止,试样本身在振动台上移动。这种布置的优点是扫描光束在显微镜的光轴上保持静止,这可以消除影响图像的大多数透镜缺陷。然而,对于生物标本,标本的移动会导致摆动和失真,从而导致图像分辨率的损失。此外,当载物台和样本移动时,不可能对样本进行各种操作,例如微量注射荧光标记的探针。
无论采用何种方式在试样上扫描照明光束,都必须产生试样的图像。明斯基的原始设计中没有形成真实的图像,而是将光电倍增管的输出转换为军用剩余长余辉示波器屏幕上的图像,该示波器没有记录功能。在他的发明首次亮相后,明斯基后来写道,他的显微镜的图像质量不是很令人印象深刻,因为示波器显示的质量,而不是因为显微镜本身的分辨率很低。现在很清楚,明斯基在1955年还没有掌握这项技术来充分展示共聚焦方法的潜力,特别是对生物结构的成像。他表示,这可能是共聚焦显微镜没有立即被生物界接受的原因,生物界过去是,现在仍然是一个对图像质量要求很高的群体。当时,他们有光学性能优异的光学显微镜,可以很容易地在高分辨率彩色胶片上查看和拍摄色彩鲜艳的组织切片。在当今的共聚焦显微镜中,图像是由光电倍增管的输出连续构建的,或者使用包含电荷耦合器件的数码相机捕获的,直接在计算机成像系统中处理,显示在高分辨率视频监视器上,并在硬拷贝设备上输出,结果非常出色。现代激光扫描共聚焦显微镜中的信息流如图4所示。
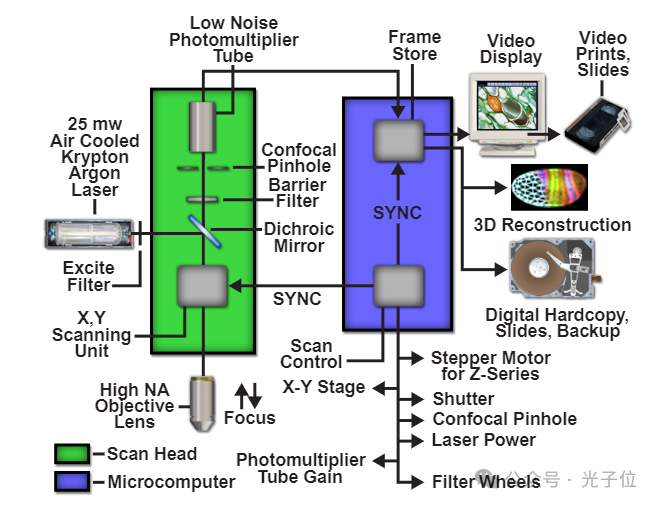
图4-LSCM信息流示意图
几十年来,光学显微镜的基本光学原理基本保持不变,因为仪器达到的最终分辨率取决于光的波长、物镜和试样本身的特性。在过去的20年里,用于增强标本对比度的染料以及与光学显微镜方法相关的其他技术得到了显著改善。共聚焦方法的发展和完善是光学显微镜复兴的直接结果,这在很大程度上是由现代技术的进步推动的。一些对明斯基共聚焦设计有益的重大技术进步已逐渐为生物学家和其他显微镜学家所用(或更实惠)。其中包括用于改进点光源的稳定多波长激光器、改进的二色镜、灵敏的低噪声光电探测器、具有图像处理能力的快速微型计算机,这些微型计算机通过提供负担得起的大容量存储芯片、复杂的图像分析软件包以及高分辨率视频显示器和数字图像打印机而得到增强。
这些技术是独立开发的,自1955年以来,已逐渐被纳入共聚焦成像系统。例如,伍兹霍尔海洋研究所的研究人员在20世纪80年代初首次有效地应用了数字图像处理技术。使用他们所谓的“视频增强显微镜”,他们能够对微管等细胞结构进行成像,这刚好超出了光学显微镜的理论分辨率。分辨率的明显提高是通过使用连接到数字图像处理器的低光级硅增强目标(SIT)摄像机对捕获的图像进行数字增强来实现的。使用微分干涉对比(DIC)光学系统对细胞结构进行成像,并使用数字处理方法进一步增强图像。
共聚焦显微镜设计的分类通常是根据扫描标本的方法进行的。扫描的两种基本方式是扫描载物台或照明光束,至少有两种根本不同的光束扫描方法。明斯基最初的设计是一个由原始音叉装置驱动的舞台扫描系统,在构建图像方面相当缓慢。从原始概念发展而来的现阶段扫描共聚焦设计主要用于微芯片行业等材料科学应用。基于这一原理的系统最近在涉及微芯片上DNA筛查的生物医学应用中变得流行起来。
对于大多数生物系统成像来说,一种更实用的替代方法是在静止的样本上扫描照明光束。这种方法是许多已经发展成为当今流行的研究显微镜的系统的基础。共聚焦显微镜所涉及的技术细节在本介绍中没有涉及,但基本上使用了两种根本不同的光束扫描方法;多光束扫描和单光束扫描。单束扫描是目前最流行的,也是LSCM中使用的方法。这里,光束的扫描最常见的是通过使用由检流计以每秒一帧的速度驱动的计算机控制的镜子来实现的。为了在接近视频帧率的情况下实现更快的扫描,一些系统使用声光设备或振荡镜。另一种方法使用两个光束进行近乎实时的扫描,通常依赖于使用某种形式的旋转Nipkow盘。这种系统源自串联扫描显微镜(TSM),经过改进,使其更有效地从荧光标记的标本中收集图像。图5显示了一个这样的改进系统,该系统采用双Nipkow盘和微透镜来增强实时图像采集的低荧光水平的检测。
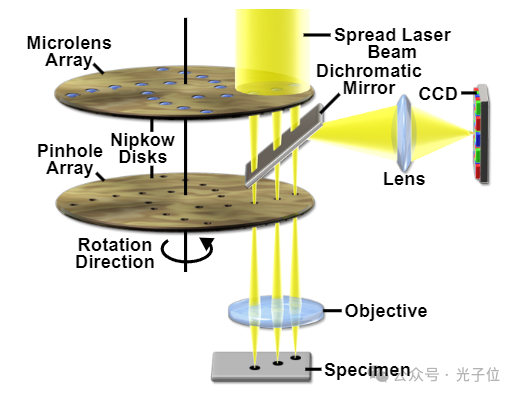
图5-Nipkow磁盘光盘配置
目前,共聚焦显微镜有两种替代方法用于制作光学切片:解卷积和多光子成像。它们在技术上有所不同,但与共聚焦方法一样,都是基于传统的光学显微镜。反卷积使用基于计算机的算法来计算和去除荧光图像中的离焦信息。由于更高效的算法和更快的微型计算机,这种技术已成为成像的实用选择。多光子显微镜使用与LSCM相同的扫描系统,但不需要探测器上的针孔孔径。针孔是不必要的,因为激光仅在焦点处激发荧光染料标签,消除了离焦发射。活体组织成像的另一个好处是,由于从激光束吸收的能量减少,样本中的光漂白减少。
传统的光学显微镜构成了LSCM构建的基础。代替钨灯或汞灯,激光被用作光源,并与灵敏的光电倍增管(PMT)探测器和计算机相结合,以控制扫描镜或其他扫描设备,并促进图像的收集和显示。采集后,图像存储在数字介质上,可以使用显微镜系统计算机或第二台计算机通过多种图像处理软件包中的任何一种进行分析。
通过LSCM的设计,照明和检测被限制在样品中的单个衍射极限点。该照明点由物镜聚焦在样本中,并在计算机控制下使用某种扫描设备进行扫描。光电倍增管通过针孔(或在某些情况下,狭缝)检测来自试样的光点序列,PMT的输出被内置到图像中并由计算机显示。虽然可以使用从标本反射回来的光来观察未染色的标本,但它们通常用一个或多个荧光探针标记。
1990年左右文献中报道的一种商业上更成功的LSCM是针对发育生物学家遇到的一个令人困惑的基本问题而设计的。免疫荧光标记胚胎内的许多结构和特定大分子在两个细胞阶段后使用传统的落射荧光显微镜无法成像,因为随着细胞数量的增加,胚胎的总体积保持大致相同。这意味着,随着细胞越来越紧密地堆积在一起,任何给定的感兴趣焦平面外的细胞发出的荧光增加都会干扰图像分辨率。

图6-尼康激光扫描共聚焦显微镜配置
一组研究该问题的研究人员发现,当时可用的共聚焦系统都无法满足他们的需求。当时的技术包括产生图像速度太慢的载物台扫描显微镜,一张图像大约需要10秒,以及多光束扫描仪器,在当时的发展中,它们不适用于荧光成像。设计了一种适用于传统落射荧光显微镜的LSCM,以及在同一时期开发的其他几种仪器,成为生物医学界现在可以从几个商业供应商那里获得的复杂仪器的先驱。
在开发的专用仪器中,可以通过调整光电探测器前针孔的直径来改变光学部分的厚度。与使用固定针孔尺寸的其他一些设计相比,这种光学变化对于成像生物结构来说非常灵活。通过减小样本中扫描区域的面积,并将扫描信息放入相同大小的数字阵列中进行存储或显示(与扫描电子显微镜中改变放大倍数的方式类似),可以在不损失分辨率的情况下缩放图像。这样做的能力为一个物镜提供了一系列放大倍数,在成像罕见或瞬态事件时非常有用,如果必须更换镜头,这些事件可能会被遗漏或位置丢失。
由于现在商业供应商提供的LSCM的复杂性和灵活性,近年来共聚焦显微镜的普及率出现了巨大的爆炸式增长,许多多用户实验室优先购买这些仪器而不是电子显微镜。共聚焦显微镜的优势在于,从为传统光学显微镜制备的标本中可以相对容易地获得极其高质量的图像,并且在当前研究兴趣的许多领域有着广泛的应用。
第一代LSCM对固定标本效果良好,但在使用激光光能方面非常浪费,并且往往会杀死活标本,除非在成像时非常小心地保持其存活能力。尽管存在局限性,显微镜产生的固定材料的图像非常好,共聚焦方法完全被生物成像专家所接受。在后续几代仪器中,成像过程的各个方面都进行了技术改进。此外,较新仪器的人体工程学和可用性得到了很大改善,因此现在通常由软件控制的对准、更改滤波器组合和调整激光功率都变得更容易、更省时。现在可以同时对多达三种荧光染料成像,并且可以按顺序对更多荧光染料成像。由于改进的、更可靠的软件,以及具有更多磁盘存储空间和更多、更便宜的随机存取存储器的更快的计算机,图像处理阶段也得到了更高的发展。

