共聚焦显微镜的主要应用是改善各种标本类型的较厚切片的成像。共焦方法的优势在于能够以高分辨率依次对单个光学切片进行成像。使用了许多不同的成像模式;所有这些都依赖于光学部分作为它们的基本图像单元。
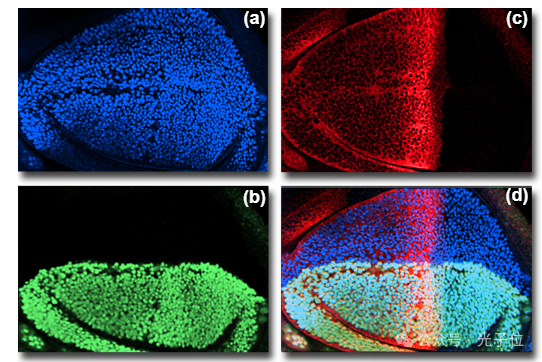
图1-三标记光学截面
单光学部分
光学部分是共聚焦显微镜方法中的基本图像单元。可以在单波长、双波长、三波长或多波长照明模式下从固定和染色标本中收集数据,从多个标记标本中收集的图像将相互对齐(如果使用具有足够色差校正的物镜)。微小的配准误差通常可以使用数字图像处理方法进行校正。大多数激光扫描共聚焦显微镜(LSCM)需要大约1秒的时间来获取单个光学切片,尽管软件通常会对几次采集进行平均以提高信噪比。图像采集的时间当然会随着图像的像素大小和系统计算机的速度而变化。保存时,大小为768 x 512像素的典型8位图像将需要约0.3 Mb的存储空间。
图1显示了使用单个氪/氩激光器在三个不同激发波长(488、568和647纳米)下同时收集的光学切片。该标本是一个果蝇三龄翅膀想象盘,标记了三个与翅膀图案有关的基因。成像的三个基因及其各自的荧光标记是:(a)退化(荧光素-496纳米);(b) 无腺体(赖氨酸罗丹明-572纳米);和(c)CiD(花青5-649纳米)。翅膀图案基因的三个空间表达域的合并复合物显示在右下角(图像(d))。
延时和活细胞成像
LSCM成像分辨率的提高增强了活细胞的延时研究。早期对细胞运动的研究是使用16毫米胶片进行的,胶片上有一个与相机相连的发条式间期计,最近还使用了延时盒式录像机、光盘录像机或视频采集卡。现在,LSCM可用于以预设的时间间隔收集单个光学切片。
用LSCM对活组织进行成像比对固定标本进行成像要困难得多,而且并不总是一种实用的选择,因为标本可能无法忍受所涉及的条件。表1列出了使用LSCM对活细胞和固定细胞成像时需要考虑的一些因素。有些标本根本不适合放在显微镜的载物台上,或者在观察期间无法在载物台保持活力。物镜视场可能无法接近感兴趣的现象或结构。例如,果蝇的翅膀想象盘在幼虫体内发育得太深而无法成像,当解剖出来时,它们无法在培养基中生长。因此,目前唯一可用于对这类组织中的基因表达进行成像的方法是解剖、固定和染色从不同发育阶段的不同标本中取出的成像盘。
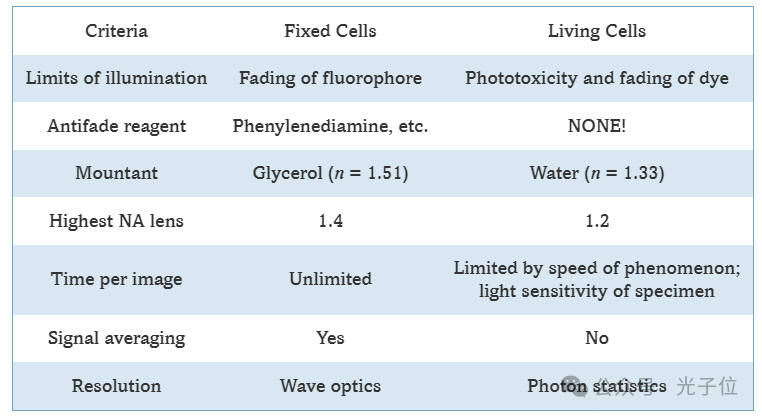
表1-LSCM对固定细胞和活细胞成像
活细胞的成功成像需要在整个成像过程中非常小心,以保持显微镜载物台上可容忍的条件。照明激光束的光损伤可能会在多次扫描中累积,因此应将光束的曝光保持在获取图像所需的最小值。抗氧化剂如抗坏血酸通常被添加到培养基中以减少氧气,氧气可以在荧光分子的激发下释放,导致自由基形成并杀死细胞。通常需要进行广泛的初步控制实验,以评估光照对荧光标记细胞的影响,并对所有成像参数进行详细记录,无论它们是否被认为相关。影像学检查后,应评估活标本的持续生存能力。例如,胚胎在成像过程后应继续正常发育,并应确定成像或使用的荧光染料引起的任何异常。图2显示了注射钙绿的活果蝇胚胎的延时成像。该系列图像显示了荧光探针分布随时间的变化。
每种待成像的细胞类型都必须满足特定的生命要求。一些细胞,如昆虫细胞,通常可以在室温下保持在足够大体积的适当培养基中。然而,大多数细胞类型都需要一个载物台加热装置,可能还需要一个灌注室,在显微镜载物台上的时间里,可以保持适当的二氧化碳平衡。选择更适合LSCM成像条件的细胞类型可以避免许多实验问题。现代共聚焦仪器的改进大大减少了潜在的问题。它们提高的光子效率、更高的数值孔径(更亮)物镜和更少的标记光毒性染料使活细胞共聚焦分析成为一种实用的选择。最好的方法是使用最少的激光功率,以实现成像并尽快收集图像。如果针孔孔径比非活体固定标本打开得更宽以加快图像采集,有时可以依靠成像后的去卷积来恢复丢失的图像质量。
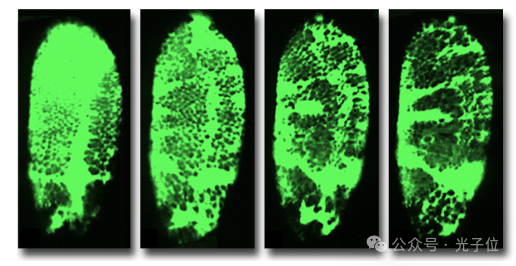
图2-延时成像
许多生理过程和事件的发生速度比大多数LSCM捕获的速度快,LSCM的图像采集速率通常为每秒一帧。使用声光器件和狭缝进行扫描的LSCM比检流计驱动的点扫描系统更快,更适用于生理研究。这些更快的设计将良好的空间分辨率与良好的时间分辨率相结合,在全屏分辨率或接近视频速率下,时间分辨率可能为每秒30帧。较慢的点扫描显微镜系统只能通过扫描样本上大大缩小的区域来实现最佳的时间分辨率。如果需要全空间分辨率,则必须减少帧的收集频率,从而损失一些时间分辨率。使用盘扫描或振荡镜扫描方法的共聚焦系统也能够对快速生理或其他瞬态事件进行成像。
Z系列与三维成像
z系列是在样本内垂直于光轴(z轴)的不同水平上收集的光学切片序列。Z系列是通过协调显微镜精细焦点的逐步变化和每一步的连续图像采集来收集的。聚焦步骤通常由计算机控制的步进电机完成,该电机以预定的增量改变焦点。计算机中的宏程序可用于获取和保存图像,根据样本中的编程距离改变焦点,获取和保存第二张图像,再次改变焦点,等等,直到收集到编程数量的图像。
可以从通过感兴趣区域拍摄的z系列中提取几个图像,并在图像处理程序中合并以突出显示感兴趣的细胞。z系列也可以显示为图像的蒙太奇,如图3所示。这种类型的图像组合和显示以及许多其他图像操作是当前大多数商业图像采集和处理软件包的标准功能。为图(图3)选择的图像代表了沿z轴显示更小增量的更大系列。绿色发光染色定位用22C10抗体标记的果蝇胚胎的外周神经系统。
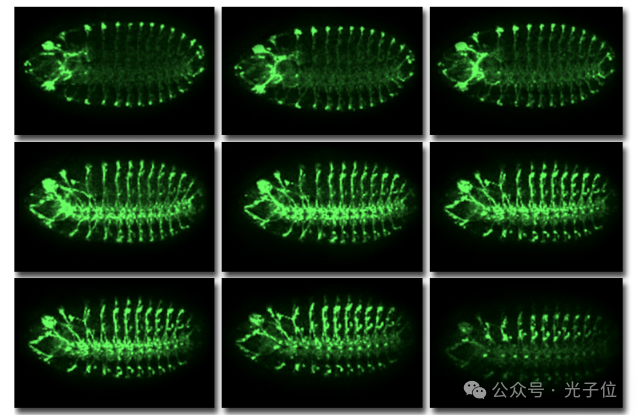
图3-Z系列光学部分
从概念上讲,很难通过LSCM在试样体积上拍摄的数百个光学切片来可视化复杂的互连结构。然而,一旦收集,z系列是使用体积可视化技术进一步处理成样本三维表示的理想选择。这种方法现在通常用于阐明生物和医学研究中组织结构和功能之间的关系。重要的是,以改变焦点的电机的适当z步长收集图像,以便在图像中反映样本的实际深度。只要样本本身在图像采集过程中没有移动,LSCM中产生的z系列就会完美对齐,并以数字格式保存,它们相对容易被处理成样本的三维表示。图4显示了单个光学切片(a)与z系列投影(b)的比较,并说明了该技术在可视化用抗体22C10染色的果蝇外周神经系统方面的价值。
步进电机所采取的步长,由显微镜操作员设置,与光学切片厚度有关,但它们可能没有相同的值。光学切片厚度是指显微镜成像的样品切片的厚度,取决于物镜和所用针孔的直径。然而,在某些情况下,聚焦步长和光学部分厚度确实具有相同的值,这可能会造成混淆。
在获取z系列文件后,通常会将其导出到专门为处理共聚焦图像而设计的计算机三维重建程序中。此类软件程序在图形工作站上以极高的速度运行,或者,使用当前更快的处理器和大量RAM,可以在个人电脑或共聚焦显微镜的工作站上非常有效地运行。三维软件包可用于生成样本的单个三维表示,或从样本的不同视图编译的电影序列,这些序列可以产生旋转或其他空间变换的效果,从而增强对样本三维特征的欣赏。该软件允许进行各种长度、深度和体积测量,并且可以交互式地更改图像的特定参数,如不透明度,以显示样本中不同水平的感兴趣结构。
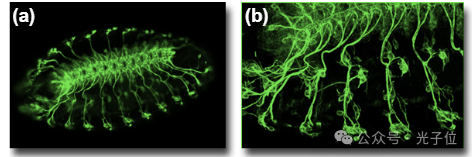
图4-光学截面和Z系列投影
另一种可能利用延时序列中的一系列光学部分的方法是将数据处理成三维表示,使时间为z轴。这是一种可视化生物体发育过程中生理变化的有用方法。使用这种方法的一个例子是阐明海胆胚胎发育过程中的钙动力学。在不同深度拍摄的颜色编码光学切片是一种显示三维信息的简单方法。在实践中,将一种颜色(通常是红色、绿色或蓝色)分配给在样本中不同深度获得的每个光学部分,然后合并彩色图像,并使用图像处理程序操纵颜色以实现所需的效果。
四维成像
活组织制剂或其他表现出动态现象的标本提供了使用LSCM收集三维数据延时序列的可能性,这些数据以时间作为第四维呈现。以时间间隔收集的Z系列数据将产生四维数据集,以时间为第四维的三维空间(x、y和Z),可以使用4D查看器程序查看。这样的程序允许在每个时间点拍摄的立体对被构建并作为电影播放,或者,每个时间点的三维重建可以被处理并显示为电影或混合画。
X-Z成像
如果需要标本的剖面图,例如上皮层的垂直切片,可以通过以下两种方式之一制作x-z切片。通过步进电机控制焦点变化,在不同的z轴深度扫描试样上的一条线(x轴),然后将该系列显示为合并图像,可以构建轮廓。另一种方法是在三维重建程序中使用切面选项,从现有的z系列光学截面中提取轮廓。在构建图5中蝴蝶翅膀上皮的图像时,激光在不同z轴位置或深度沿单线(左侧图像中的水平黑线)扫描,进入样本。图5中显示的x-z图像是由共焦成像系统构建和显示的。翼上皮由两层上皮组成,但随着荧光强度在标本更深处下降,只有上层清晰可见。
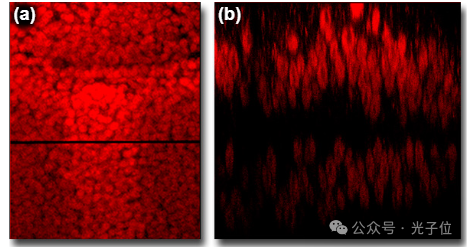
图5-X-Z平面成像
反射光
成像反射或背散射光成像是所有早期共聚焦显微镜中使用的成像模式。许多标本可以在LSCM中使用反射光在未染色状态下观察到,或者可以用高反射性的探针标记标本,如免疫金或银粒。反射光法的一个优点,特别是对于活组织样本,是光漂白不是问题。某些类型的探头可能会衰减激光束,另一个潜在的问题是,在某些显微镜中,光路中的光学元件可能会发生内部反射。在狭缝或多光束版本的LSCM中不存在反射问题,在麻烦的仪器中,使用偏振器或远离伪影和光轴的成像可以缓解反射问题。
透射光成像
显微镜中常用的任何透射光成像模式都可以用于LSCM,包括相位对比、微分干涉对比(DIC)、暗场或偏振光。透射光探测器用于收集穿过试样的光,光纤光导将信号传输到显微镜系统扫描头中的光电倍增管之一。透射光图像和共聚焦落射荧光图像可以使用相同的照明光束同时采集,确保所有图像都对齐。当使用图像处理软件组合或合并图像时,可以绘制组织内标记细胞的精确位置。一些研究中的一种信息方法是将样本的透射光非聚焦图像与同一样本中标记细胞的一个或多个共聚焦荧光图像相结合。例如,使用这种方法可以确定未标记细胞群中标记细胞子集在数小时甚至数年内迁移的空间和时间方面。
现在引入了一种彩色透射光探测器,它收集在红、绿、蓝(RGB)颜色通道中传输的信号,以类似于一些数码彩色相机的方式创建真实的彩色图像。这种检测器对病理学家特别有用,他们习惯于在透射光中观察组织的真实颜色,并将这些图像与荧光数据叠加。

