设计上的改进简化了共聚焦显微镜,使其成为细胞生物学的标准研究工具。然而,随着共聚焦显微镜变得越来越强大,它们对光学元件的要求也越来越高。事实上,在广角显微镜中引起图像质量细微缺陷的光学像差可能会在共聚焦显微镜中产生毁灭性的影响。不幸的是,共焦显微镜的严格光学要求往往被保证清晰图像的光学系统所掩盖,即使显微镜性能不佳。光学制造商提供各种显微镜物镜,每种物镜都是为特定应用而设计的。本报告展示了物镜设计中涉及的权衡如何影响共聚焦显微镜。
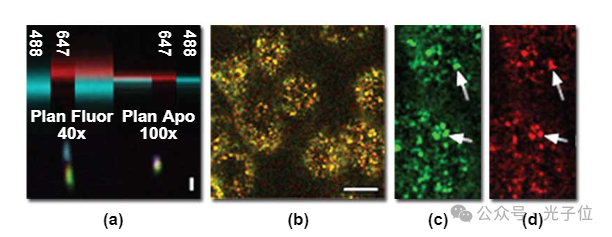
图1-双物镜的色差
在过去的十年里,共聚焦显微镜已经从一种仅限于显微镜专家的技术发展成为一种标准的研究工具。其应用的激增既源于共聚焦显微镜技术的快速发展,也源于商业共聚焦显微镜系统用户界面的成熟。最新的系统几乎是转钥系统,即使是新手显微镜师也可以快速收集高质量的图像。具有讽刺意味的是,刺激共聚焦显微镜在实验生物学中传播的相同技术发展也推动了共聚焦显微镜光学的极限,使理解共聚焦显微镜的光学特性比以往任何时候都更重要。
共聚焦显微镜最常见的应用是比较同一细胞中多个探针的分布或行为。由于共聚焦显微镜的发展,这些研究成为可能,共聚焦显微镜能够有效地收集多种颜色的荧光,并开发出新的染料,扩展了荧光显微镜的有用光谱。根据显微镜的配置,此类研究可能需要使用从紫外到红外波长的光学元件。随着定量显微镜比色方法的发展,对精确彩色成像的要求进一步提高,例如离子浓度的荧光比测量。
无色差只是光学设计方程的一部分,光学设计还考虑了单色像差和参数,如高光子效率、场大小、场平坦度、工作距离以及深入水生物组织成像的能力。由于显微镜光学系统的设计反映了这些不同参数的折衷,制造商通常会设计各种不同的显微镜物镜,每种物镜代表一组特定的设计权衡,每种都适合特定的应用。这里讨论的研究表明,显微镜物镜的选择会对共聚焦显微镜实验的结果产生深远的影响。他们强调了仔细选择适合实验应用的显微镜物镜的重要性。
理想的透镜会将所有颜色的光聚焦到同一点。事实上,所有透镜都有色差,这是一种不同颜色的光聚焦到不同点的特性。当通过显微镜目镜观察样品时,这种缺陷会使物体看起来有彩色边缘。当在彩色共聚焦显微镜中对样品进行成像时,这种缺陷会导致不同颜色的激发照明聚焦到样品中的不同点,并从样品的不同点收集不同颜色的发射。图像平面中的水平位移,称为横向色差,会导致不同颜色的不同放大倍数。通过将分析限制在显微镜视野的中心,可以最大限度地减少这个问题。然而,沿着焦轴的垂直颜色位移,称为轴向色差,存在于整个显微镜视野中。对于任何试图使用彩色共聚焦显微镜来确定多个探针的相对分布的研究人员来说,这显然是一个问题。图1至图3中显示的图像显示了彩色共聚焦成像的结果如何严重依赖于显微镜物镜的性质。
这些数字提供了平面荧光40x物镜与平面复消色差100x物镜性能的比较,前者设计用于最大限度地传输紫外光,后者设计用于最小色差。对于比较的一个方面,使用488或647纳米的光收集了玻璃盖玻片表面反射的垂直系列图像。由于不同颜色的光被单个表面反射,因此没有色差的透镜会将不同颜色的光线聚焦到同一焦平面上。当以垂直截面再现时,用理想镜头收集的图像将显示一条水平线,其中两种颜色完全重叠。图1(a)上半部分的图像显示了玻璃反射的xz截面,焦点(z)轴垂直取向,并证明平面复消色差仪100x物镜在接近这一理想值方面做得很好,将两种颜色的光分辨到彼此相距0.1微米以内的深度。相比之下,最小校正的40x平面荧光物镜检测到647纳米光的反射,大约比488纳米光高1.2微米。在玻璃反射的图像中,647纳米光以红色显示,488纳米光以蓝色显示。刻度条指示1微米的距离。
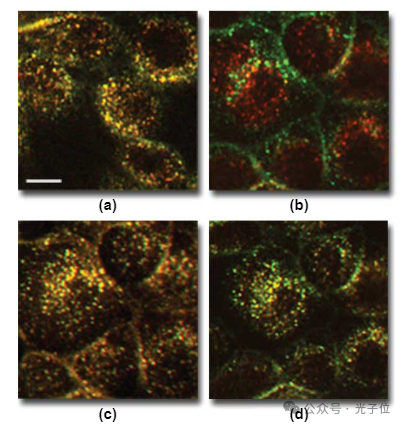
图2-轴向色差校正
这种垂直差异的影响在荧光中很明显。该面板的下半部分(图1(a))显示了用三种荧光团标记的珠子图像体积的垂直横截面。当用100倍平面复消色差物镜成像时,三种颜色是重合的,从而得到一个白色、相当圆的图像。相比之下,40x物镜产生的图像中,远红色荧光(680纳米发射,用蓝色表示)明显垂直于红色(600纳米)或绿色(520纳米)荧光。此外,远红色荧光的轻微水平位移反映了横向色差。
为了提供生物测试样本,利用了内体可以通过用荧光标记的内吞配体孵育细胞来标记的事实。每个内体中包含的大量分子确保了每个内体都含有相同比例的荧光探针。因此,内体提供了一种极好的彩色共聚焦成像测试,因为它们在生物样本中呈现了亚溶液对象,其颜色将反映每个荧光团的相对荧光贡献。图1(b)显示了使用100x平面复消色差物镜收集的细胞的彩色图像,其中内体已被荧光素(F-Tf,发出绿色荧光)和Cy5转铁蛋白(Cy5-Tf,发射远红色荧光)标记。两种探针的共定位在单个内体的恒定黄橙色中很明显,在F-Tf(图1(c))和Cy5-Tf(见图1(d))的高倍图像比较中更为明显。在这些图像中(图1(b)至图1(d)),比例尺表示10微米的长度。
然而,当切换到40x平面荧光物镜时,即使在红色和绿色荧光之间,焦平面的细微差异也很明显,如用Tf标记的细胞所示,Tf与荧光素和罗丹明结合(图2(a))。远红色和绿色荧光之间焦平面的差异导致F-Tf和Cy5-Tf的表观分布存在惊人的差异,现在似乎完全不同(图2(b))。
对于一个正在评估各种探针相对分布的细胞生物学家来说,这些位移将产生灾难性的后果。通过将图像体积的整个垂直序列求和到一个投影中,可以避免焦平面的差异,从而消除两种颜色焦平面差异的影响(图2(c))。投影中每个内体的一致黄色表明每个内体中两个探针的比例恒定。然而,由于该过程丢弃了所有垂直信息,因此很少是呈现共聚焦图像的合适方式。通过测量不同颜色的轴向偏移并组合从适合每种颜色的焦平面收集的图像,也可以最小化轴向色差的影响。图2(d)显示了该程序的一个示例,其中显示了用40倍平面荧光物镜收集的相距1.2微米的绿色和远红色组合图像。图2图像中的比例尺表示10微米的长度。当比较单个探头的图像时,通过组合来自不同焦平面的图像实现的校正是显而易见的,如图3所示。尽管图3(a)和图3(b)显示了在同一焦平面收集的图像中F-Tf和Cy5-Tf之间的分布不一致,但图3(c)和图2(b)的比较表明,远红色图像可以与1.2微米深的绿色荧光图像叠加。在这些图像中(图3(a)至图3(c)),比例尺对应于5微米的长度。
虽然色差会导致不同颜色的光聚焦到图像体积中的不同点,但球面像差会大大降低共聚焦显微镜中的信号。球面像差透镜将轴向和外围光线聚焦到不同的点,从而模糊点光源的图像。就像共焦针孔通过拒绝离焦光来有效地提高图像对比度一样,它有效地消除了用球面像差成像的物体的大部分荧光。
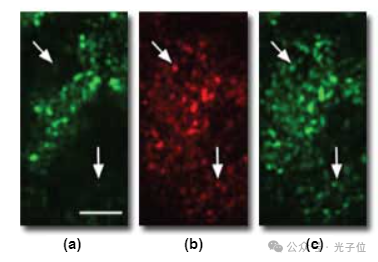
图3-彩色焦平面校正
对于许多样品,球面像差的主要来源是浸没介质和安装介质的折射率之间的差异。直到最近,最高分辨率、最佳校正的显微镜物镜都是为使用油作为浸没液而设计的。对于这些物镜,只有当整个光路具有浸油的折射率(与玻璃的折射率相同)并且随着距离的增加而累积到具有不同折射率的介质中时,球面像差才会最小化。由于大多数样品,特别是活体样品,都安装在折射率明显低于浸油的介质中,因此球面像差限制了使用浸油物镜的图像体积的深度。
图4显示了共聚焦显微镜中球面像差的影响,其中油浸式100倍平面复消色差物镜用于收集标记有F-Tf的细胞图像,并将其安装在0微米(盖玻片表面)(图4(a))或35微米的水性介质中(图4)。在这两种情况下,内体看起来轮廓分明,但进入水性介质的35微米光路的累积球面像差严重损害了图4(b)中的荧光信号。在图4所示的每张图像中,比例尺表示10微米的长度。
最近,光学制造商通过设计使用水作为物镜浸没介质的物镜来解决这个问题。对于水样,浸没和样品介质的匹配折射率使球面像差与成像深度无关。这使得这些物镜能够在工作距离允许的情况下尽可能深地收集图像,通常在样品中收集数百微米的图像。该设计的成功如图4((c)和(d))所示,其中显示了用F-Tf标记的细胞的图像,这些细胞使用60倍平面复消色差物镜在水性介质(图4(c))或66微米处收集。这里,荧光信号不受通过含水样品介质的光路的影响。这种新一代的高数值孔径平面复消色差水浸物镜极大地帮助共聚焦显微镜实现了其在三维生物成像中的潜力。
这种水浸物镜的颜色性能介于前面讨论的油浸式平面荧光和平面复消色差物镜之间。图5(a)上半部分玻璃表面反射的横截面图像显示,647纳米光在488纳米光上方聚焦约0.6微米。在水性介质中收集0或63微米体积的类似模式表明,这种差异与成像深度无关。
图5(a)中左下角的图像显示,这种颜色差异导致三重标记珠的远红色图像与红色或绿色荧光图像的远红色区域发生位移。在荧光珠图像中,520纳米发射以绿色显示,600纳米发射以红色显示,680纳米(远红色)发射以蓝色显示。该面板的右下角展示了盖玻片厚度校正在最小化此类物镜球面像差方面的关键重要性。由于球面像差的校正取决于通过盖玻片的光路长度,因此可以通过根据盖玻片厚度设置的轴环进行调节。由于球面像差的校正取决于通过盖玻片的光路长度,因此可以通过根据盖玻片厚度设置的轴环进行调节。左侧的胎圈横截面是在将套环设置为测量的盖玻片厚度(174微米)的情况下收集的,右侧的图像是在套环调整为150微米时收集的。由于轴环设置不当导致的球面像差严重衰减了荧光信号,并损害了垂直分辨率。尽管选择这种失调是为了突出这一点,但我们强调,在实践中很容易遇到这种错误,因为盖玻片的实际厚度在其标称值附近可能会变化40微米以上。只有通过测量单个盖玻片才能确保正确的衣领设置。在图5(a)中的所有图像中,焦轴垂直取向,比例尺表示1微米的距离。

图4-球面像差
图5(b)和图5(c)所示的图像是用F-Tf和Cy5-Tf标记的细胞场,并在63微米的深度收集到水性缓冲液中。在这两幅图像中,比例尺代表10微米。虽然图像看起来很清晰,但该物镜的轴向色差会使F-Tf和Cy5-Tf的分布显得离散(图5(b))。尽管如此,这些细胞的垂直图像序列的投影(图5(c))表明,这两种探针可以平等地标记所有内体。与图5(a)所示的反射图像一致,在0微米深度(盖玻片表面)收集的内体图像中,轴向色差同样明显。在用与荧光素和罗丹明结合的Tf标记的内体图像中,红色和绿色荧光的焦平面几乎没有差异(图6(a)),但F-Tf和Cy5-Tf似乎再次标记了离散的内体群体(图6)。
当考虑焦平面的差异并将Cy5-Tf图像与0.6微米深收集的荧光素图像结合时,可以更好地比较两个探针的分布。两个探针的共定位现在在图6(c)所示的内体的恒定黄色中很明显。当将Cy5-Tf图像与0.6微米深的F-Tf图像(图6(F))进行比较时,在单个焦平面收集的图像中显示的两个探针分布的明显差异(图6)和图6(e))消失了。比例尺表示图6(a)至图6(c)中的10微米长度,对应于图6(d)至图5(f)中的5微米。
色差的影响也可以通过测量用多个探针标记的内体图像中的荧光比来量化。图7(a)显示了用F-R-Tf标记的细胞的比率直方图的半对数图,其中使用100倍平面复消色差仪(红色曲线)、40倍平面荧光仪(蓝色曲线)和60倍平面复消色差水浸物镜(绿色曲线)收集了图像。图7(b)显示了使用相同三个目标标记F-Tf和Cy5-Tf的细胞的比率直方图。图7(a)显示,对于所有三个目标,罗丹明与荧光素(红与绿)的排放比都是相当恒定的。相比之下,图7(b)显示,虽然100倍平面复消色差仪在Cy5与荧光素(远红与绿)的比例上仍然显示出最小的变化,但水浸60倍平面复消色差仪显示出更多的变化,而40倍平面荧光仪显示出更大的变化。当将单个焦平面的分布与每个物镜的垂直图像序列投影中测量的分布进行比较时,60x平面复消色差和40x平面荧光中的色差影响更为明显(分别为图7(c)和图7(d))。在每种情况下,投影图像中荧光比的窄分布报告了内体中两个探针的几乎恒定的比率,这在任何单个焦平面图像中都是错误的。
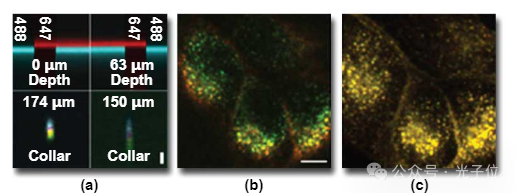
图5-浸水时的色差和球面像差
这里展示的研究生动地展示了色差和球面像差如何影响共聚焦成像的性能。同时,他们强调了共聚焦显微镜中客观选择的至关重要性。差的颜色校正将导致对多个探针相对分布的错误解释,这是共聚焦显微镜的主要应用之一。比率定量还展示了色差如何影响显微镜定量。由不匹配的浸没和样品介质引起的球面像差会降低垂直分辨率,并可能完全消除荧光检测。尽管在共聚焦显微镜提供的高对比度图像中特别明显,但这些误差也会损害传统落射荧光和透照技术收集的图像。
色差主要针对紫外荧光团进行表征。其他结果表明,远红色也有明显的轴向色差,随着新型远红色荧光探针和能够激发它们的激光器的开发,显微镜学家越来越多地使用这一范围。尽管这里介绍的研究涉及点源的表征,但这些样本很容易显示出用更广泛的探针会显现(但不一定明显)的问题。此类探针包括经常用于离子浓度荧光比测量的细胞质染料。
例如,细胞质pH指示剂SNARF-1的荧光被488纳米的光激发,pH值是通过580纳米处的荧光与640纳米处荧光的比率来测量的。对于薄细胞胞浆pH的测量,很容易想象荧光比如何受到细胞相对于绿色激发光、红色发射和远红色发射的单独焦平面的位置的影响。尽管这些误差通常只会增加测量值的变化(在所呈现的量化中,标准偏差增加一倍或三倍),但它们也会系统地影响比率测量,例如,在比较不同厚度单元不同部分的比率时。
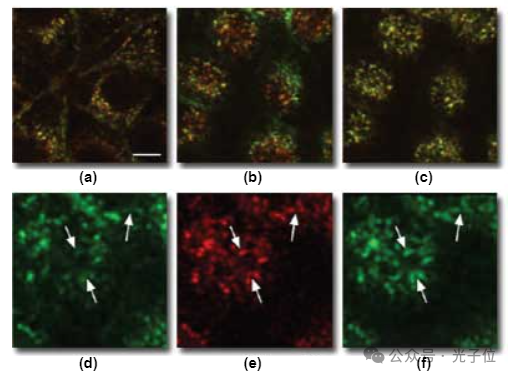
图6-浸水物镜的轴向色差
色差的最后一个后果,虽然这里没有讨论,是它如何影响荧光检测。在具有色差的共聚焦系统中,激发和发射波长之间的差异导致一个体积的激发和不同体积的成像,从而衰减荧光信号。对于光束扫描系统(大多数共聚焦显微镜),随着成像点离共聚焦针孔越来越远,这种信号损失会随着离轴距离的增加而加剧。
必须强调的是,这些观察结果并不是所提供数据中使用的特定目标或特定制造商所独有的。在Quantum和Diaphot显微镜架上的三个60倍水浸物镜和两个100倍油浸物镜的例子中,颜色校正的特征得到了相同的再现。每个主要制造商的物镜都存在明显的轴向色差。事实上,色差的普遍存在导致了替代显微镜设计的发展,这些设计通过施加特殊的辅助校正透镜或完全避免折射并转向反射物镜来解决色差问题。尽管如此,显微镜光学可能会继续发展,股份有限公司尼康新一代CFI60光学的初步经验表明,轴向色差校正有了很大改进。
从表面上看,有些目标似乎比其他目标更好。然而,如前所述,目标设计代表了设计参数的折衷。因此,每个目标都根据其预期应用反映了一组不同的设计折衷方案。尽管如此,研究人员可能需要比目前光学设计更多的东西,迫使他们设计不超出客观设计极限的实验。
如果必须使用油浸物镜对水性介质中的样品进行成像,例如在活细胞研究中,可以通过最小化穿过水性介质的光路或使用折射率适合水性光路引起的球面像差的油来最小化球面像差。
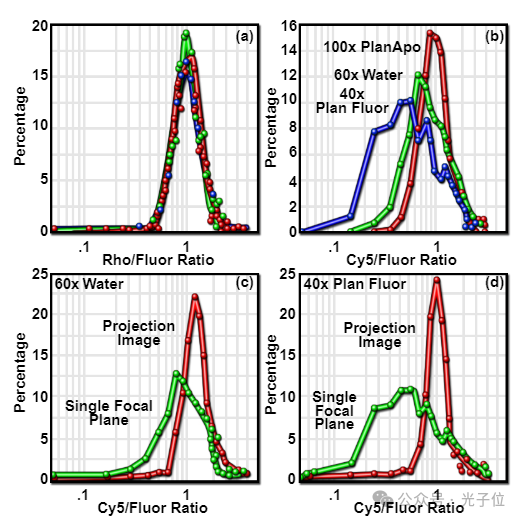
图7-量化和色差
色差问题可以通过多种方式最小化。如果一个特定的实验需要使用具有明显色差的物镜,最明显的解决方案是完全避免使用远红色荧光染料,如Cy5。本综述中讨论的结果表明,绿色和红色荧光与所有测试目标之间的一致性令人满意。一般来说,最好使用在特定物镜校正的特定波长附近具有最大激发和发射的染料。第二种解决方案,如上所述,是在一系列垂直焦平面中收集每个荧光团的图像,并根据两者之间焦平面的差异组合不同颜色的图像。这是一个简单的解决方案,但在需要快速图像采集时(如活细胞)是不合适的。此处未显示的分析也表明,该解决方案没有足够的精度来校正用于比率量化的图像。一种更昂贵(或不太容易获得)的解决方案是使用双光子显微镜,只要不使用探测器针孔,它就不会受到色差的影响。然而,它的多色能力现在才被探索。

