在过去的十年中,已经开发了广谱高性能荧光团,用于使用激光点扫描共聚焦、旋转盘、多光子和全内反射等先进技术进行荧光显微镜研究。目前可用的先进探针包括基因编码的荧光蛋白、半导体量子点、由靶向蛋白质融合的膜渗透性合成荧光团组成的混合系统,以及表现出广泛物理和光谱特性的独立合成物。这些试剂能够靶向活细胞或固定细胞中的几乎任何蛋白质或肽,许多试剂也非常有用,可以作为生物动力学的指标。当用作单个标签时,大多数荧光团的成像都很简单,可以很容易地用标准照明器和荧光滤光片组完成。然而,当使用两种或多种荧光探针的组合时,研究人员应该意识到由于荧光团之间的光谱重叠而在检测通道中发生信号交叉的可能性。
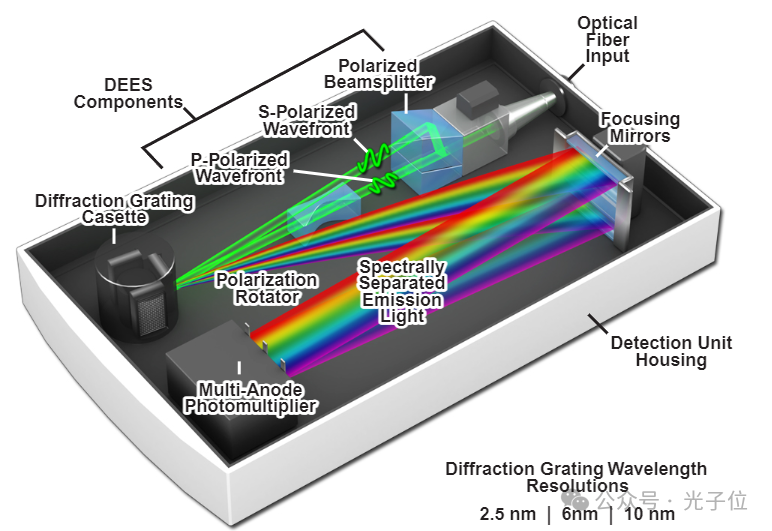
图1-尼康增强型光谱检测单元
先进的研究显微镜能够在单个实验中使用单、双、三或四波段二色镜以及与被分析探针的发射光谱轮廓相匹配的相关激发和发射滤光片组对多个荧光团进行成像。不幸的是,许多合成荧光团和荧光蛋白的发射光谱分布跨越了大约50至150纳米的波长带,导致一个探针的发射信号可能渗透到另一个探针预期的检测通道中。当荧光探针的选择受到限制,或者在同一样本中同时针对两种以上的荧光蛋白进行研究时,情况会更加复杂。由于研究活细胞和固定细胞中多个探针之间的相互作用所提供的信息水平大大超过了单独使用相同标记所提供的水平,因此已经开发了一些方法来解开复杂的发射信号混合物,从而可以单独分辨光谱。在这方面领先的是一种称为光谱成像的技术,该技术与测量的光谱轮廓的数学线性解混相结合,代表了光学成像和分子光谱学的协同结合,目前可用作各种商用广角和激光扫描共聚焦显微镜上的辅助硬件和软件组件。
图1所示为高性能尼康A1共聚焦显微镜光谱探测器单元的剖面图,该单元能够在单次扫描中高速采集多个光谱轮廓。光谱探测器通过光纤连接到扫描单元,光纤的波长分辨率与共焦针孔直径无关。进入探测器的荧光发射光首先通过专有的衍射效率增强系统(缩写为DEES),该系统使用偏振分束器将入射的非偏振发射光分离为两个正交的偏振光波前(称为p和s)。DEES系统的目的是通过用于将荧光发射分离为分量波长的光栅来提高光衍射的效率。离开分束器后,使用棱镜系统将p波阵面旋转90度(变成s偏振波),然后两个光束被三个可互换光栅中的一个衍射。衍射光栅可以精确控制以确保高水平的再现性,其波长分辨率为2.5、6和10纳米。使用10纳米光栅,可以在一次扫描中获得320纳米范围内的光谱。光栅衍射的光谱不同波长被两个独立可调的柱面镜聚焦到32通道多阳极光电倍增管上,使得每个光束(法线s波和旋转p波)产生的聚焦点完美重叠。一种特殊的屏蔽机制可以通过多达四个激光器同时激发混合荧光团。
受益于光谱成像与基于软件的线性解混算法的许多应用中,有一些应用需要在发生显著程度的光谱重叠的情况下,能够破译各种吸收染料和荧光团的单个光谱轮廓。使用光谱成像方法可以增强涉及活细胞成像(动物和植物)、免疫荧光、核型分析、临床病理学、流式细胞术、体内成像和药物发现的研究。使用这种技术获得的光谱信息通常可以区分测量伪影,如自发荧光、折射率波动、未被怀疑的荧光团相互作用和环境不均匀性,并从作为实验方案目标的探针中获得所需的信号。除了在去除可能掩盖许多标本细节的不需要的自发荧光方面的实用性外,光谱成像在分离动态荧光共振能量转移(FRET)实验中荧光蛋白和其他荧光团的重叠发射光谱方面也是一个显著的优势,这些实验通常因对极快图像捕获的要求而变得复杂。
荧光串扰
根据分子结构和元素组成的细微细节,任何特定荧光团的荧光发射光谱都可以分布在30至200纳米的宽波长范围内。为了证明这一概念,图2中给出了由假想荧光团产生的“通用”吸收和荧光发射光谱。该图所示的光谱分布具有所有荧光团共有的特征,发射分布近似(但不完全)吸收分布的“镜像”。在光谱分布的较短波长区域,随着曲线接近最大值(称为峰值发射波长),发射光谱的量子产率急剧增加。在峰值之后,随着波长的继续增加,光谱轮廓的斜率下降得更慢,直到回到基线时达到最小值。荧光发射的带宽通常通过最大量子产率50%处的光谱轮廓宽度来测量,通常称为半峰全宽(FWHM;图2)。然而,从图2中的轮廓可以观察到,在该区域外的较长波长(在某些情况下超过100纳米)中产生的荧光发射量可能很大。
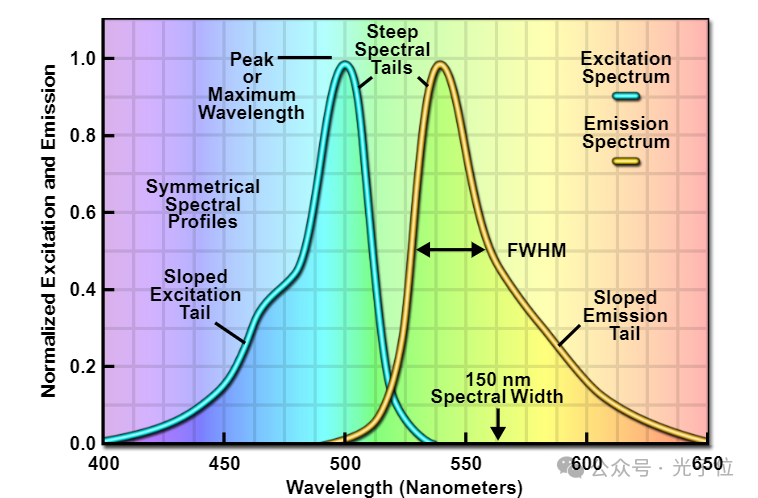
图2-荧光激发和发射光谱
当在荧光显微镜中用单个荧光团成像时,可以使用长通发射滤光片来收集宽光谱范围内的最大发射量。在这种情况下,不必担心由另一个荧光团的发射重叠引起的信号干扰(通常称为交叉、渗出或串扰)。然而,当同时对多个荧光标记成像时,发射轮廓通常共享相同的光谱区域,特别是在较长的波长中,并且需要以单个荧光团的峰值波长附近为中心的受限波长带通发射滤光片,以限制或优选地消除对其他荧光团发射的不必要检测。即使使用窄带滤光片,一个荧光团的发射也会渗入另一个荧光基团的检测通道。当使用具有窄发射光谱轮廓(通常为30至60纳米)的合成染料或量子点时,这个问题不太严重,但当对两个或多个荧光蛋白成像时,问题会变得更加严重,这些荧光蛋白的发射光谱通常跨越数百纳米。请注意,整个可见光谱区域的宽度限制在约300纳米(约400至700纳米)。因此,同时对两种分离良好的荧光蛋白进行成像,每种荧光蛋白的发射光谱分布跨越150纳米,将在可见光谱的很大一部分上产生可检测的信号。
可以检测到的荧光发射信号的水平由发射滤光片通带的宽度和荧光团激发的效率决定,这是一个由荧光团的吸收光谱分布与激发滤光片的通带宽度决定的因素。因此,即使在荧光团的发射轮廓有显著重叠的情况下,如果仔细选择激发滤光片波长通带特性,它们也可能不会产生可检测的串扰。此外,由于激发效率在比吸收峰周围波长更长的波长处急剧降低(见图2),具有最长波长吸收特性的荧光团通常可以被特异性激发,而不会同时激发在较短波长下吸收的荧光团。例如,当对增强的青色(ECFP)和黄色(EYFP)荧光蛋白(具有高度重叠的发射光谱;见图3(b))进行成像时,可以通过首先激发和检测EYFP,然后使用旨在最小化EYFP激发的激发和发射滤光片对较短波长的ECFP进行成像来最小化串扰。该技术依赖于使用带通发射滤光片的顺序成像,这些滤光片通常只能检测到每个荧光团发射的可用光子的50%或更少。此外,当使用具有太多光谱重叠或异常斯托克斯位移的荧光团(如ECFP和EGFP;见图3(c))时,这种方法将不会有效。
图3所示为表达两种荧光蛋白的几种组合的计算机模拟活细胞,以证明荧光成像中的光谱交叉。这些细胞是在细胞核中表达ECFP的印度麂皮成纤维细胞(通道1),以及EGFP、EYFP或单体Kusabira Orange荧光蛋白(mKO)作为细胞骨架丝中β-肌动蛋白的融合物(通道2)。每个探头组合的光谱重叠区域在光谱图中显示为滤波器窗口内的灰色区域。这些荧光蛋白组合显示出不同程度的发射光谱重叠。ECFP和mKO的组合(图3(a))显示了最小的重叠量,ECFP标记的核在通道2(mKO通道)中没有显示出实质性的信号。相比之下,ECFP和EYFP的组合(图3(b))显示出更多的重叠,核在通道2中变得清晰可辨。最后,ECFP和EGFP的组合显示了最高程度的光谱重叠(图3(c)),通道之间存在明显的信号交叉。
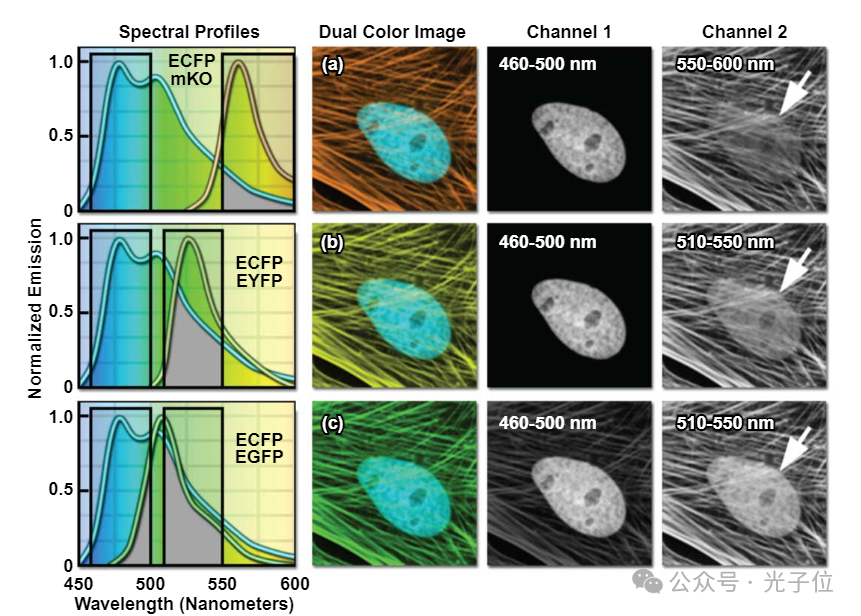
图3 -荧光团串扰或透光
试图在单个实验中使用三种或更多荧光蛋白需要使用更严格限制的激发和发射过滤策略。在大多数情况下,对两个或多个荧光团进行成像会导致一些不良后果,包括由于顺序成像的必要性而导致的速度限制,由于滤波器通带尺寸较小而导致的灵敏度降低,以及为尽量减少光谱重叠而必需的更复杂的标记策略。顺序收集图像比同时成像需要更多的时间,采集过程中样本的快速运动可能会影响结果。此外,活细胞中的荧光团信号水平通常较低,特别是对于目标丰度稀疏的样本或内源性水平表达的样本。因此,使用有限通带滤波器进行检测可能具有挑战性。未混合数据集的信噪比通常超过窄带通发射滤波器获得的信噪比较高,因为荧光探针的整个150纳米以上的发射带宽都可以是样本,而不仅仅是30纳米的窄发射窗口。最后,荧光蛋白调色板仍然相当有限,宽的发射曲线使得难以干净地分离发射,否则需要专门的滤光片组。因此,在活细胞成像中,高速采集通常是实验成功的关键因素,这些后果可能会对研究结果产生严重影响。
显微镜光谱学
光谱成像将显微镜和光谱学的学科融合在一起,能够确定图像中每个像素的样本的强度和光谱特性。成像领域的最新技术进步产生了高度复杂的数码相机和点源探测器(如光电倍增管),能够在多种对比增强技术下,包括明场、相位对比和荧光显微镜,从各种标本中创建具有高空间分辨率和动态范围的信息丰富的图像。这些探测器的进步还扩展了创建微弱荧光样本的合适图像的能力,这些样本的低信号水平之前在噪声基底中丢失了。相比之下,光谱学是一个成熟的领域,涉及在定义的波长带上收集和分析光强度值的定量集合,该波长带可以包含电磁辐射光谱的任何部分。在显微镜中,光谱成像技术通常仅限于从近紫外到近红外的波长范围。
原子和分子具有固有的能带结构,可以用光谱学进行检测。简而言之,光吸收过程将电子从基态激发到更高的能级,从该能级开始,电子可以通过多种途径弛豫,包括衰变回基态,同时发出较低能量的光(荧光)。能级是每个分子的固有属性,因此为该分子提供了精确的光谱指纹。在荧光中,特定分子(称为荧光染料或荧光团)附着在感兴趣的结构上,用作成像的光源。荧光显微镜中需要注意的一个重要概念是,荧光团浓度与荧光强度之间通常存在直接的线性关系,尤其是在低浓度下。这种情况使得在必要的信号可以成功地与饱和、光转换和光漂白效应分离的情况下,可以对荧光进行定量分析,这些效应往往会破坏预期的线性。
与荧光不同,在其他形式的光学显微镜中,包括明场、增强对比度透射模式(相位对比;霍夫曼调制对比度,HMC;微分干涉对比度,DIC)、反射光和散射,样品用外部宽带光源照射,检测器在与样品相互作用后测量相同的光。为了分析光谱数据,必须考虑光源发出的光谱,并且测量的信号通常与样品中发色团或吸收物种的浓度不成正比,除非首先根据比尔-朗伯定律将其转换为光密度单位。然而,大多数用吸收染料染色并使用明场技术成像的细胞和组织是光谱成像分析的主要候选者。
为了测量吸收染料、荧光团或具有多个标记的完整样本的光谱,首先将透射或发射的光分散到其成分波长中,并测量每个波长或非常窄的波长带的强度。光谱分辨率取决于每次测量的带宽,并且随着采样通道带宽的减小而增加。各种不同的技术可用于分散光,其中大多数已被应用于显微镜场景(至少在原型仪器中)。测量光谱时需要考虑的最重要特征包括分辨率、波长范围和动态范围。光谱分辨率由可以相互区分的最近波长决定,是高精度光谱成像测量的关键参数。光谱范围是指特定测量中的波长总数(实际上是带宽)。最后,检测限和动态范围分别定义了进行测量所需的最小信号电平和特定测量中可区分电平的数量。所有这些值都可能因每种荧光团或吸收物种的光谱特征而异。
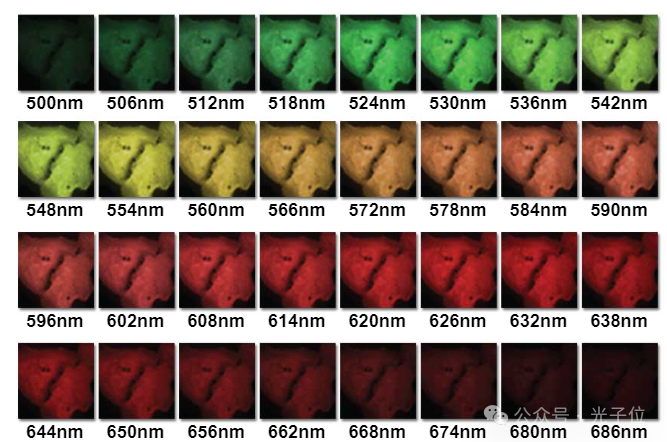
图4-32通道光谱图像Lambda堆栈采集
图4展示了一组典型的光谱图像,这些图像是在500至692纳米的波长范围内,以6纳米的连续带宽采集的,以生成包含32幅图像的lambda堆栈(下文将详细讨论)。该样本是贴壁人宫颈癌(HeLa系)细胞的培养物,其中DNA和RNA使用吖啶橙染色,并用尼康A1光谱共聚焦显微镜系统成像。使用488纳米激光激发,以每秒24帧的速度使用32通道多节点光电倍增管记录图像(512 x 512像素)。这种在活细胞成像中具有显著优势的高采集速度是通过先进的信号处理技术与与光电倍增管串联工作的快速模数转换电路相结合而实现的。
光谱成像注意事项
由于需要分析包含反射、折射和散射阳光以及阴影数据的卫星图像,光谱成像的复杂技术首先出现在遥感领域,所有这些数据都在同一场景中。光谱分析方法旨在从图像数据集中表征多个频率,以区分在各种景观和地形中观察到的物体。类似的技术也用于其他应用,从检查材料的化学成分到阐明恒星和星系形成的机制。因此,通过检查强度波动作为光谱频率(波长)的函数,将单个像素与匹配的光谱信息相关联,可以发现在简单分析使用混合频率的光捕获的单个图像时被掩盖的新细节。
一般来说,卫星和天体数据集比从用一两个探针标记的生物标本图像中获得的数据集更复杂,因为光谱类别的数量通常要大得多。无论如何,卫星图像的光谱特征在复杂性上与检查活细胞中重叠荧光蛋白的混合物或用几种吸收染料(如曙红和苏木精)标记的固定组织样本时获得的光谱特征相似。在过去的几年里,应用于卫星成像的独特方法已成功转移到宽视场和激光扫描共聚焦显微镜中的生物标本分析中,用于许多应用,包括消除自发荧光伪影、检测弱和卷积的Förster共振能量转移(FRET)信号、人类染色体的核型分析,以及逐像素解开共定位荧光团。由此产生的光谱信息可用于以高空间精度精确定位特定荧光团和染料的位置,并且还可能产生有关两个或多个探针之间相互作用的信息。
在常规情况下,在实验协议允许的情况下,通过仔细选择荧光探针和相关滤光片组,以及通过实施具有适当控制的多跟踪扫描策略来产生合理的荧光团信号分离,可以成功应用传统的共聚焦和宽场成像技术。不幸的是,越来越多地使用多种荧光蛋白颜色(及其相关的高度光谱重叠)来监测细胞内相互作用,这往往限制了实验参数的选择。此外,在使用单个荧光团的活细胞成像中,天然自发荧光会显著干扰最受欢迎的绿色荧光探针(如增强型绿色荧光蛋白)可见的通道中的检测。通过使用固定剂或DNA转染试剂引入的外来荧光也会严重加剧这种背景噪声问题。在荧光探针光谱明显重叠或自发荧光过高的情况下,可以利用光谱成像结合使用线性解混算法的采集后图像分析来解开混合荧光信号的角度,并清楚地分辨出每个荧光团的空间贡献。
光谱图像Lambda堆栈
在概念上类似于使用激光扫描共聚焦或反卷积显微镜中的高数值孔径物镜从较厚的标本中获得的光学截面(或z堆叠),λ堆叠是一个三维数据集,由使用不同波长带采集的相同标本场的图像集组成,每个波段跨越2至20纳米的有限光谱区域。相比之下,所有形式的光学显微镜中的典型成像场景都涉及在探测器的整个波长响应带上采集单个图像(或延时实验中的连续图像组)。因此,虽然传统成像会为图像中的每个像素产生强度值(I(x,y)),但分光光度计测量只提供单个光谱(I(λ))。lambda堆栈通过在每个像素处提供光谱值(I(x,y,λ))来合并这些值,以创建可以被视为图像集合的图像,其中每个图像都是在不同波长(或窄带波长)下采集的,或者可以被认为是每个像素位置的不同波长值的集合。
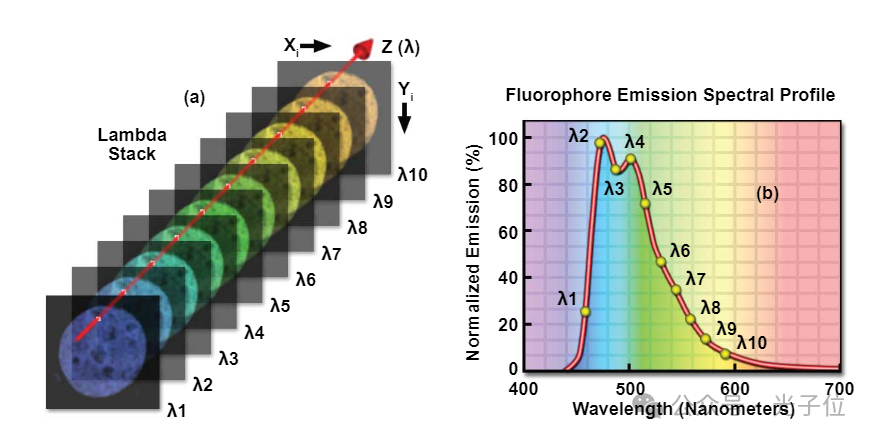
图5-光谱成像Lambda堆栈解剖
为了更好地理解lambda堆栈概念(在文献中也通常称为图像立方体或光谱立方体),可以沿着波长(zλ)轴检查横向图像维度中的单个像素位置(具有坐标xi,yi)。如图5(a)所示,当从λ堆栈的一端监测到另一端时,像素i的强度和/或颜色分别随荧光发射信号强度和波长而变化。通过在线性图上绘制像素强度与波长的关系图(见图5(b)),可以很容易地确定位于像素i的特定荧光团的发射光谱分布。应该指出的是,使用这种技术获得的发射光谱的准确性和分辨率是在不同波段收集的λ堆叠图像数量、每个波段的光谱宽度(以纳米为单位)(带宽越短,分辨率越高)、所研究样品的物理质量以及探测器的光子灵敏度(量子效率)的函数。
在激光扫描共聚焦显微镜上获得的λ堆栈的一个现实世界的例子,在活细胞中使用三种荧光蛋白具有重叠的光谱,如图6所示。本实验使用的荧光蛋白标记物为水母增强绿色荧光蛋白(EGFP);发射最大值为507纳米),水母增强黄色荧光蛋白(EYFP);发射最大值为527纳米),以及Kusabira Orange (mKO,发射最大值为561纳米)的单体版本,这是一种从天然珊瑚蛋白中开发出来的高性能探针。在这种情况下,在480至640纳米的10纳米波段扫描单个λ堆叠图像(图6(a)),为荧光蛋白混合物生成总共16个光谱部分。
λ堆叠的第一张图像显示了样本在480至490纳米发射范围内的光谱特征,而第二张图像包含490至500纳米的发射数据(见图6(b))。请注意,前两个λ部分中的几乎所有荧光发射都来自EGFP的短波长尾部,而EYFP在较长波长部分(490至500纳米)的贡献非常小。在接下来的两个λ部分(500至510纳米和510至520纳米),随着EGFP的发射达到平台,EYFP的贡献稳步增加。在520至550纳米之间的三个λ段中,EGFP信号开始下降,因为EYFP发射的贡献在大约530纳米处达到最大值。同样,mKO的发射贡献在540至550纳米之间的波段变得更加显著。因此,在550至560纳米波段,EGFP、EYFP和mKO的荧光蛋白的相对贡献分别约为10%、25%和65%。
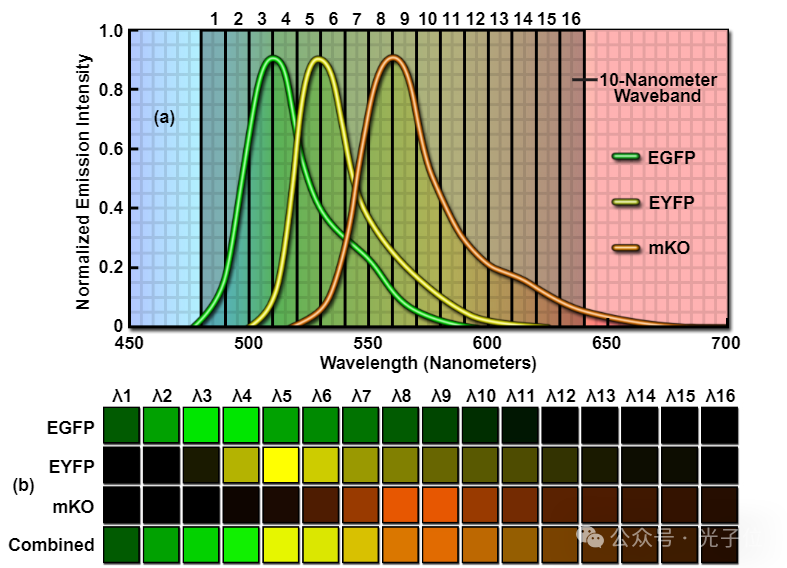
图6-绿色、黄色和橙色荧光蛋白的Lambda堆栈
由于mKO的发射占主导地位,EGFP和EYFP的发射贡献在最终波长带(560至640纳米)中减弱。在回顾中,λ堆叠的极端波长带(480至500纳米和590至640纳米之间)的发射贡献分别由最短和最长波长的发射蛋白质EGFP和mKO主导。λ堆叠中心的那些波长带(500至590纳米)包含荧光发射,代表了所有三种荧光蛋白的一些贡献。如下面将讨论的,使用来自每个探针的参考发射光谱轮廓,可以线性地不混合λ堆叠的波长带上的混合发射信号的分布,以清楚地分离单个荧光蛋白的贡献。
光谱成像技术
光谱成像光学显微镜的主要仪器考虑因素是能够准确地将荧光发射或未被样品吸收的源光分离到其成分波长中。已经实施了许多不同的方法来使用各种探测器设计在宽视场和共聚焦显微镜中生成lambda堆栈。用于光谱成像的经典共聚焦仪器设计由棱镜或衍射光栅组成,将发射光束分散到其成分光谱中,然后将其传递到多阳极光电倍增管,该光电倍增管可以同时检测多达32个单独的光谱信息通道。另一种常见的设计是使用狭缝将选定的波长传递到一个探测器,并将更短和更长的波长反射到额外的狭缝。最近,两个线性可变滤波器的组合,一个用作短通,另一个用作长通,已被证明是一种自由定义光谱通道的优雅方法。宽场仪器利用干涉滤光片、声光可调滤光片(AOTF)、液晶可调滤光片、干涉测量、棱镜、耦合到反射器的棱镜或光栅来生成用于图像分析的λ堆叠。
在用于生成lambda堆栈的许多技术中,所谓的波长扫描方法可能是最简单的方法。在实践中,使用一系列窄带通干涉滤光片(通常为5至20纳米宽)来收集每个滤光片的视场图像。或者,可以使用具有特别尖锐截止波长的短通和长通滤波器的组合来代替带通滤波器。使用滤光片时,带通尺寸决定了每个λ扫描中包含的波长数量,从而决定了光谱分辨率。发射滤光片放置在位于试样和探测器之间的滤光片轮中,以便在轮将新滤光片旋转到位后,获取同一试样场的连续图像(见图7(a))。一般来说,基于滤光片的光谱成像技术仅在需要有限数量的波段的情况下才实用,因为每个滤光片都必须重复扫描样本,这通常会导致过度的光漂白。这种方法的更复杂和活细胞友好的版本使用线性可变滤波器的组合来快速自由地定义光谱通道。
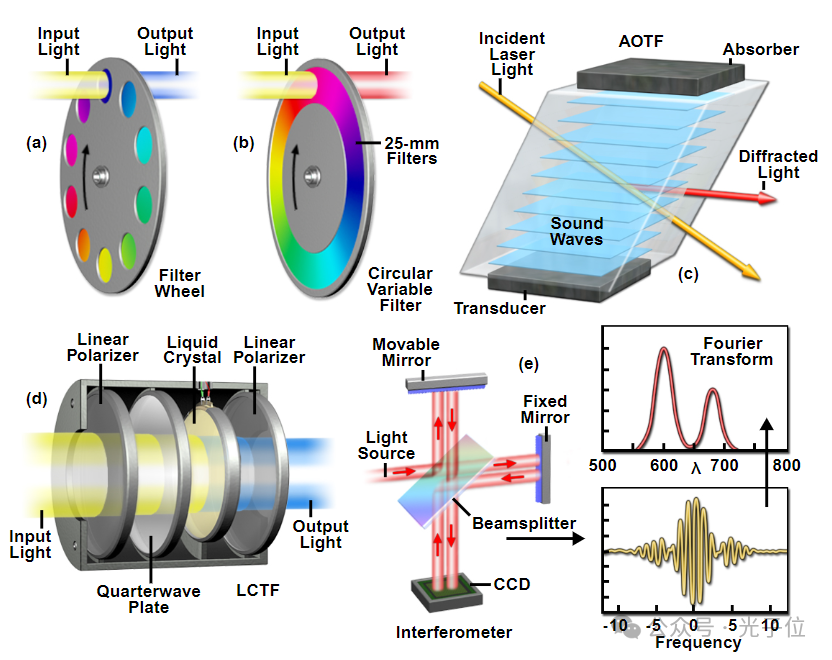
图7-光谱成像光调节技术
获得波长扫描λ堆栈的一种更方便的方法是使用可变滤波器(见图7(b)),该滤波器可以精细调谐,提供更多波长带,并且通常比滤波器轮更紧凑。最广泛使用的可变滤波器配置基于可变光谱干涉滤波器和电可调光学滤波器。圆形可变滤光片包含干涉滤光片,其根据入射光穿过滤光片的位置在空间上改变波长通带。在实践中,滤波器被放置在与滤波器轮相同的位置,并被旋转以改变通带。线性变量过滤器被转换,并且可以堆叠。基于AOTF和LCTF设计(见图7(c)和7(d)),有几种光谱探测器可供选择,它们将可调滤光片放置在照明源和试样之间(当使用电弧放电灯等宽带源时)或试样和探测器之间。不幸的是,由于偏振和散射伪影,在样本和探测器之间放置AOTF或LCTF可能会导致传输效率低下。
AOTF和LCTF滤光片的主要优点是,它们是没有运动部件的电光元件,与滤光轮和基于狭缝的系统相比,能够快速切换。当向安装在两个线性偏振器之间的可偏振液晶施加电压时,液晶可调谐滤波器通过传输窄带波长来工作。在大多数实现中,需要几个阶段来实现高分辨率光谱分离,这一条件也减少了滤光片通带内的总透光量。当传输非偏振光(如荧光发射)时,标准LCTF的光通量约为40%。如果非偏振光首先穿过偏振分束器,并且正交偏振LCTF用于反射和透射光,则效率可以加倍。然后,可以用两个单独的探测器检测过滤后的光,或者将其与另一个偏振分束器重新组合成一个探测器,图像可以并排放置或叠加(后者需要精确配准)。利用这两种偏振图像可以计算荧光偏振各向异性图像,这在用荧光蛋白进行FRET测量时特别有用。
声光可调滤波器采用一种特殊的晶体化合物,如二氧化碲,它通过晶格变形来响应声波。在每个声频下,晶体变形以产生具有特定周期的衍射光栅,该衍射光栅透射不同的波长(或窄带波长)。这两种滤波器设计都通过捕获不同波段的连续图像来生成lambda堆栈,并具有非常高的光谱分辨率的优点。此外,操作员可以为每个单独的波段选择最佳曝光时间。不利的一面是,如上所述,当在发射光学序列(在样本和探测器之间)中使用AOTF滤光片时,由于光通量差以及图像模糊和偏移伪影,AOTF滤光片可能会出现问题。一些制造商已经生产出图像质量的AOTF设备。声光分束器(AOBS)也用于共聚焦显微镜,其功能基于与AOTF相同的概念。
光谱成像时间扫描方法基于获取一个数据集,该数据集表示光谱和空间信息的叠加,但也需要对收集到的数据进行数学变换以导出光谱图像。在实践中,该技术不需要滤光片或棱镜,通常通过将干涉仪单元(图7(e))耦合到荧光显微镜进行傅里叶变换成像光谱,在广角显微镜中实现。干涉测量方法将入射光束分成两条单独的路径,并在两条光束之间引入具有时间延迟的光程差。当到达探测器(CCD或光电倍增管)时,两个光束能够干涉。通过测量作为光程差函数的强度,可以创建特定于试样光谱特性的干涉图。然后,可以通过将傅里叶变换算法应用于干涉图来导出原始光谱。成像光谱学最显著的优点是在整个实验过程中收集每个波长的强度,并且可以通过调整采集参数来简单地调节分辨率。唯一的缺点是,即使只需要几个数据点,也必须收集样本的整个光谱。由于缺乏商业仪器,成像光谱学通常在定制的仪器上进行。
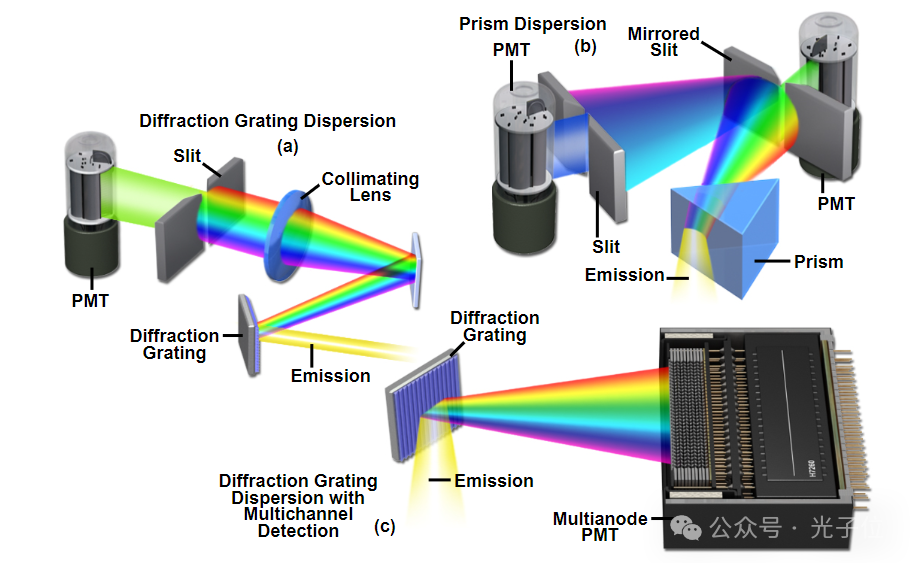
图8-共聚焦显微镜光谱成像探测器配置
快速发展的流式细胞术技术也可以从光谱成像技术中受益。由于流式细胞术在成像时的空间限制,光谱成像是通过选择较小的感兴趣区域(通常具有单个细胞的尺寸)并限制收集的波段数量来进行的。因此,荧光发射被衍射光栅或定制光学元件分散,并投影到时间延迟积分(TDI)CCD的表面上,传感器像素时钟与流速同步。类似的方法利用计算机断层扫描,其中全息色散元件将光谱和空间信息投影到面阵CCD上。一般来说,CCD相机速度是光谱成像的主要限制,因为收集单个λ堆栈需要几分钟或更长时间。然而,更快系统的出现可以帮助克服这些陷阱。数码相机还需要重复扫描以捕获λ堆栈,这可能会导致光漂白和光毒性增加。在活细胞成像中,速度情况要关键得多,因为标记结构可以在采集耗时几分钟的lambda堆栈期间改变空间位置。

