导语: 心肌梗死及其后再灌注治疗所引发的损伤,是心血管研究领域的热点。构建稳定可靠的动物模型是开展相关研究的第一步。今天,我们就来详细拆解一下经典的小鼠左冠状动脉前降支(LAD)结扎术,教你如何一步步构建MI和I/R模型。收藏这一篇,实验成功率大大提升!
一、模型原理简介
顾名思义,这个模型的核心就是通过结扎心脏的左冠状动脉前降支(LAD),人为地制造心肌缺血。
二、实验前准备
1. 实验动物:
2. 主要仪器与试剂:
麻醉剂: 1-2% 异氟烷(吸入麻醉)或 戊巴比妥钠(腹腔注射)
ventilator(动物呼吸机):至关重要,保证手术过程中小鼠正常呼吸。
手术器械: 精细剪刀、镊子、持针器、7-0或8-0无菌缝合线、开胸器、加热垫。
其他: 碘伏消毒液、生理盐水、棉签、剃毛器、心电图(ECG)仪(可选,用于实时监测)。
3. 术前准备:
三、手术操作步骤(图文关键点)
第一步:气管插管与呼吸机连接
在颈部正中做一微小切口,分离肌肉暴露气管。
小心地将一根24G静脉导管插入气管,确认插入后,迅速连接到呼吸机上。
设置呼吸机参数(潮气量:0.8-1.2 ml,呼吸频率:110-120次/分钟),确保胸廓起伏规律。
小贴士: 气管插管是手术成败的关键之一,操作需迅速准确,避免损伤喉部。
第二步:开胸与心包切除
在左侧第3、4肋间区域,用剪刀斜切开一个约1cm的切口。
用开胸器轻轻撑开肋间隙,暴露心脏。
用精细镊子小心地撕开心包膜,清晰暴露左心室和左心房,可以看到LAD血管(通常位于左心耳下缘与肺动脉圆锥之间)。
第三步:冠状动脉结扎
用7-0或8-0的无损伤缝合线,在LAD起始部下约2-3mm处进针。
将一小段PE管(约1-2mm)置于血管与线之间,然后打一个活结(用于I/R模型)或死结(用于MI模型)。
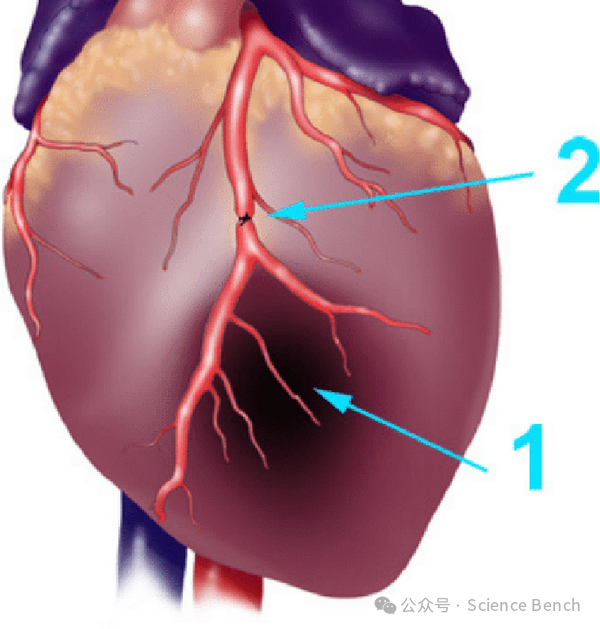
成功缺血标志: 结扎后立即观察左心室前壁区域会变得苍白,搏动减弱,心电图ST段显著抬高(如果连接了ECG)。这表明结扎成功。
第四步:区分MI与I/R模型
第五步:术后复苏与护理
断开呼吸机,等待小鼠自主呼吸恢复后,小心拔出气管插管。
将小鼠置于37℃加热垫上保温,直至完全清醒。
连续3天皮下注射镇痛药(如布普renorphine,0.1mg/kg)和抗生素(如青霉素),减轻动物痛苦并预防感染。
提供软食和饮水,密切观察状态。
四、模型成功性验证
存活率: 熟练操作后,术后24小时存活率应>80%。
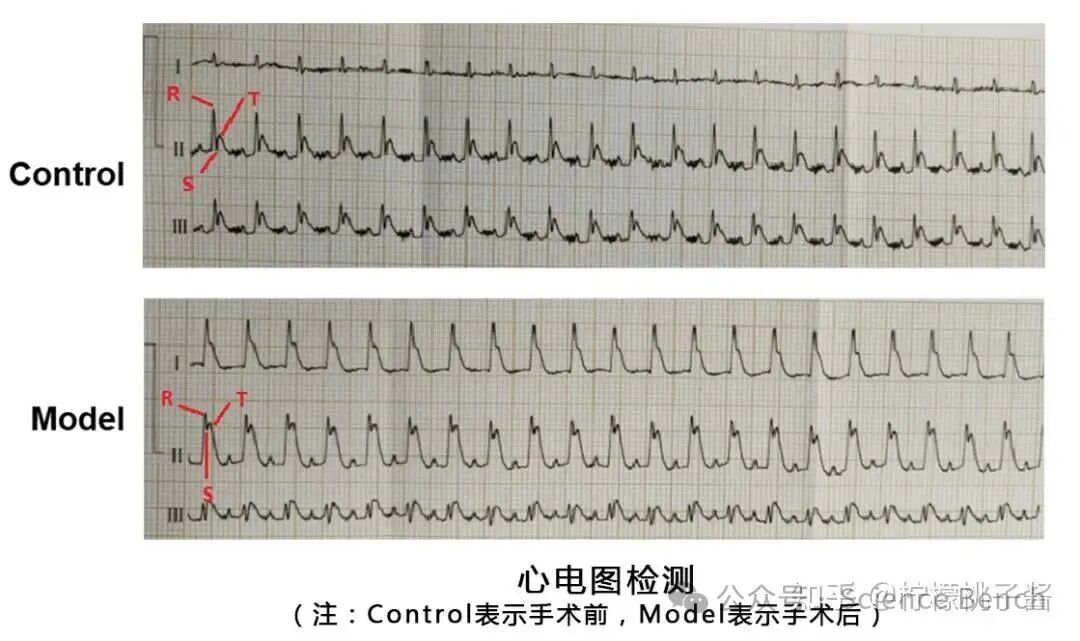
心电图: 术后持续监测可见病理性Q波、ST-T段改变。
心脏超声: 术后1-4周进行超声检查,可评估心功能(EF、FS值显著下降)和梗死区室壁运动异常。
TTC染色: 处死动物后取心脏进行TTC染色,梗死区域呈苍白色,而非梗死区呈砖红色,可定量计算梗死面积。
组织学染色: HE染色观察心肌细胞坏死、炎症浸润;Masson染色观察胶原沉积(纤维化)。
五、常见问题与注意事项
死亡率高: 主要原因可能是气管插管失败、气胸、出血过多或结扎位置不对。勤加练习是唯一途径。
梗死面积不稳定: 结扎位置LAD的解剖变异是主要原因。尽量保证所有小鼠结扎位置的一致性。
动物福利: 务必做好术后镇痛和护理,这是伦理要求和获得稳定数据的保障。
假手术组: 对照组需进行假手术(即完成所有步骤但不结扎LAD),以排除手术创伤本身的影响。
结语
构建稳定的小鼠MI/I/R模型需要精细的操作和丰富的经验。希望这篇详细的教程能为大家的科研之路提供帮助!从第一步开始耐心练习,你一定能掌握这项核心技术。
记得点赞、收藏、转发给需要的伙伴哦!

