标本在显微镜下的结构不一定完全真实。显微形态和真实形态之间的差别,一部分是组织缺氧造成的改变,比如细胞皱缩、肿胀和染色不良等,这在尸检取样的标本中较常见。大多数动物实验和手术取材的标本,更主要的失真原因来自显微制片和生物染色等操作。这些因人为加工引入的结构改变统称为人工假象(artifact)。
理解人工假象,须了解标本制备的基本过程。传统的常规光学显微制片,通常始于化学固定;经过脱水剂浸透,置换掉组织中的水分子;然后浸入熔化的石蜡液中,用石蜡置换掉脱水剂,冷凝后成为兼具支撑硬度和切削韧性的蜡块;再用锋利的切片刀在切片机的帮助下把蜡块上的组织标本切成2 ~ 10 μm的薄切片;切片漂浮在温水表面展平,用经过防脱处理的载玻片捞起,烤干后切片与载玻片紧密贴合;最后,用染色剂溶液对重新水化的切片进行染色。
在这一系列加工的每个环节,都可能产生人工假象。比如,固定剂、脱水剂造成的收缩(图A)、溶解(图B)、碎裂、膨胀等,以及切片和裱贴环节产生的刀痕、褶皱(图C)、小叶结构散开(图D)等。即使到了染色环节,仍可能引起诸如龟裂(切片干燥所致)、染色异常(溶液酸碱性调节失误)等假象。在标本制片工作中,同时处理各组标本,在实验阅片工作中,设立充分的对照,对准确识别真正的结构变化十分重要。
冷冻制片和电子显微制片同样存在人工假象。冷冻制片中,不少细胞呈现濒临死亡的形态表现,也可能呈现为冰晶损伤后的空洞(图E)。这些事实上是冻伤的结果,不能提示病理改变。电镜下人工假象常表现为收缩、变形、刀痕、染色不良或染色剂污染。电镜的放大倍率更高,分辨能力也更精细,但电镜观察中可见的人工假象并不比光镜观察更少。
标本固定不足,可能造成部分细胞的染色加深,表现为同一类细胞中,有部分细胞整体看上去变“暗”(图F)。该现象在光镜和电镜下都能观察到。脑、肝脏、软骨、肿瘤组织等,如果尺寸偏大并以浸泡方式固定,由于深部不能及时浸透,经常产生这类假象。标本取材过程中的机械损伤,有时也表现为细胞变暗。不过,并非所有部位的暗细胞都是人工假象。比如,脊神经节、睾丸间质细胞、汗腺等部位,正常情况下本来就有明细胞和暗细胞,分别代表了不同的功能状态,这就不是人工假象了。脑室管膜、肾集合小管等部位,上皮细胞在接触固定液的瞬间,胞内含水量可能明显不同,固定后收缩程度不一,也可能产生明暗差异。此外,在固定充分的前提下,病变或即将坏死的细胞,染色后通常显示为“暗”细胞;这一规律有助于判断肿瘤细胞或体外培养的细胞是否具有正常活性。
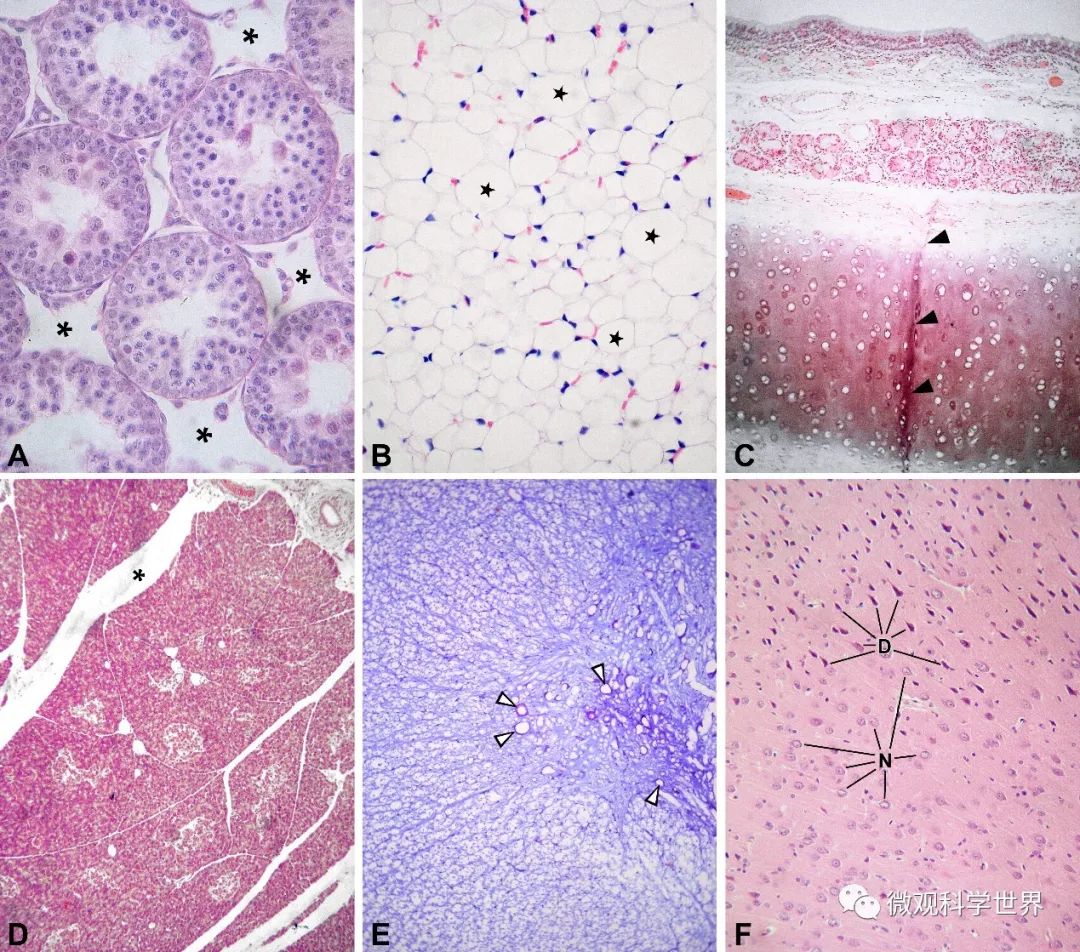
常见人工假象示例 (A)脱水剂造成睾丸生精小管收缩,高倍;* 示小管之间产生的菱形空隙;(B)脂肪细胞中的脂质被脱水剂溶解,高倍;★ 示脂质空泡;(C)切片和裱贴操作引起的气管软骨局部褶皱,低倍;▲ 示褶皱染色后的形态;(D)展片过久或水温过高造成胰腺小叶彼此分离,低倍;* 示分离形成的裂隙;(E)冷冻制片过程中细胞冻伤,低倍;△示冰晶损伤的神经细胞;(F)大脑皮质固定不足和机械力作用产生的“暗”细胞,低倍;N 正常细胞,D 暗细胞。
上述人工假象中,有的容易避免,有的受技术所限,尚难完全根除。因此,认识人工假象,对显微阅片工作非常必要。镜下观察时,如果抛开对照标本或无视人工假象而解读标本的微观形态,很可能得出错误的研究结果或诊断意见。

