
我院何祖平研究团队最新研究发现,YAP1通过与RAD21相互作用,并靶向NEDD4调控人精原干细胞的命运决定和男性不育。相关成果以“Essential Regulation of YAP1 in Fate Determinations of Spermatogonial Stem Cells and Male Fertility by Interacting with RAD21 and Targeting NEDD4 in Humans and Mice”为题发表在《Research》上。
近年来我国人口出生率逐年下降,不孕不育是该社会问题的重要原因。其中,由男性因素所致的不孕不育约占50%。精原干细胞(Spermatogonial stem cells, SSCs)作为精子发生的起始细胞,其自我更新与分化的动态平衡对精子发生至关重要。然而,精原干细胞命运决定的机制目前尚不清楚,进行精原干细胞命运决定的机制研究为理解精子发生障碍的病因提供重要的科学依据。
研究表明,Yes相关蛋白1(Yes-associated protein 1,YAP1)参与了肿瘤发生、干细胞的自我更新与分化、胚胎发育、器官大小调节及细胞可塑性等多种生物学过程。然而,目前尚无YAP1参与人精原干细胞命运决定的相关研究。
团队前期研究发现,PAK1可通过PDK1等靶基因调控人精原干细胞的命运。将人精原干细胞PDK1敲低后,YAP1基因和蛋白表达量下降,提示YAP1可能在人精原干细胞命运调控中发挥重要作用。
团队在该研究中对777例生精障碍患者的全外显子测序数据进行了生物信息学分析,发现16例患者中存在12处YAP1基因单核苷酸变异(Single nucleotide variation,SNV)(2.06%,16/777),包括1例纯合突变及15例杂合突变,均为新发变异或罕见变异。随后对上述变异进行了患病风险分析及致病性预测,结果筛选出2处可能的有害变异,即YAP1 c.134C>T(p. P45L),YAP1 c.680C>T(p. S227L)。INPS-MD、MAESTROweb预测显示,这2处YAP1基因SNVs均损害YAP1蛋白质结构的稳定性。接下来,在人精原干细胞系中构建了YAP1 P45L、S227L突变体,观察突变体对YAP1蛋白表达及细胞功能的影响。蛋白稳定实验显示,YAP1 S227L突变体降低YAP1蛋白的稳定性。功能实验表明,与野生型相比,YAP1 S227L突变体的人精原干细胞的DNA合成减少,凋亡增加。同时,发现非梗阻性无精子症患者(NOA)睾丸组织中YAP1蛋白表达量降低(图1)。可见,YAP1突变或低水平表达与人类非梗阻性无精子症存在相关性。
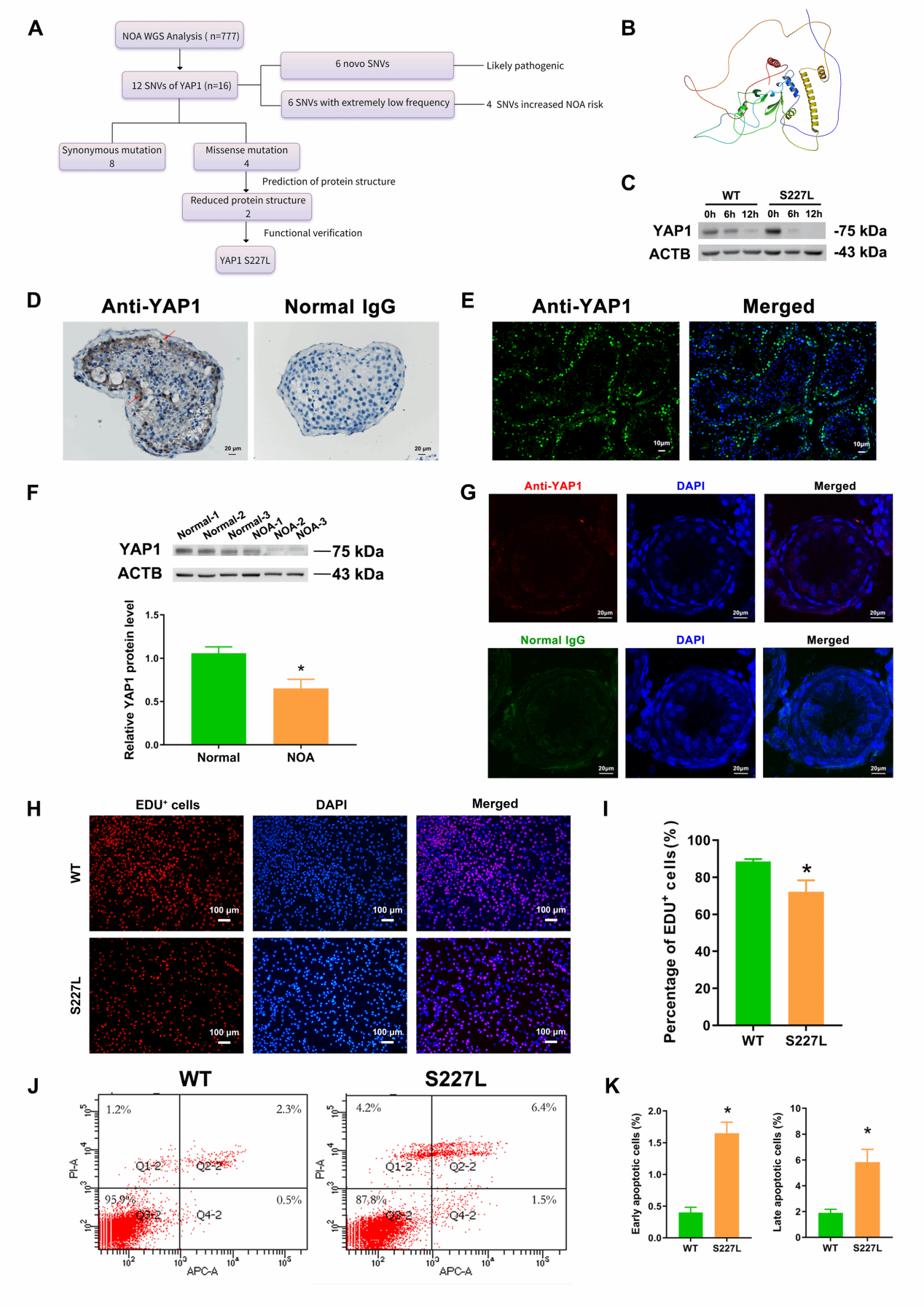
图1. YAP1 SNVs与非梗阻性无精子症的相关性
接下来,研究团队在体内外水平分别论证了YAP1敲低可抑制人精原干细胞系的增殖和DNA合成,促进其凋亡(图2)。
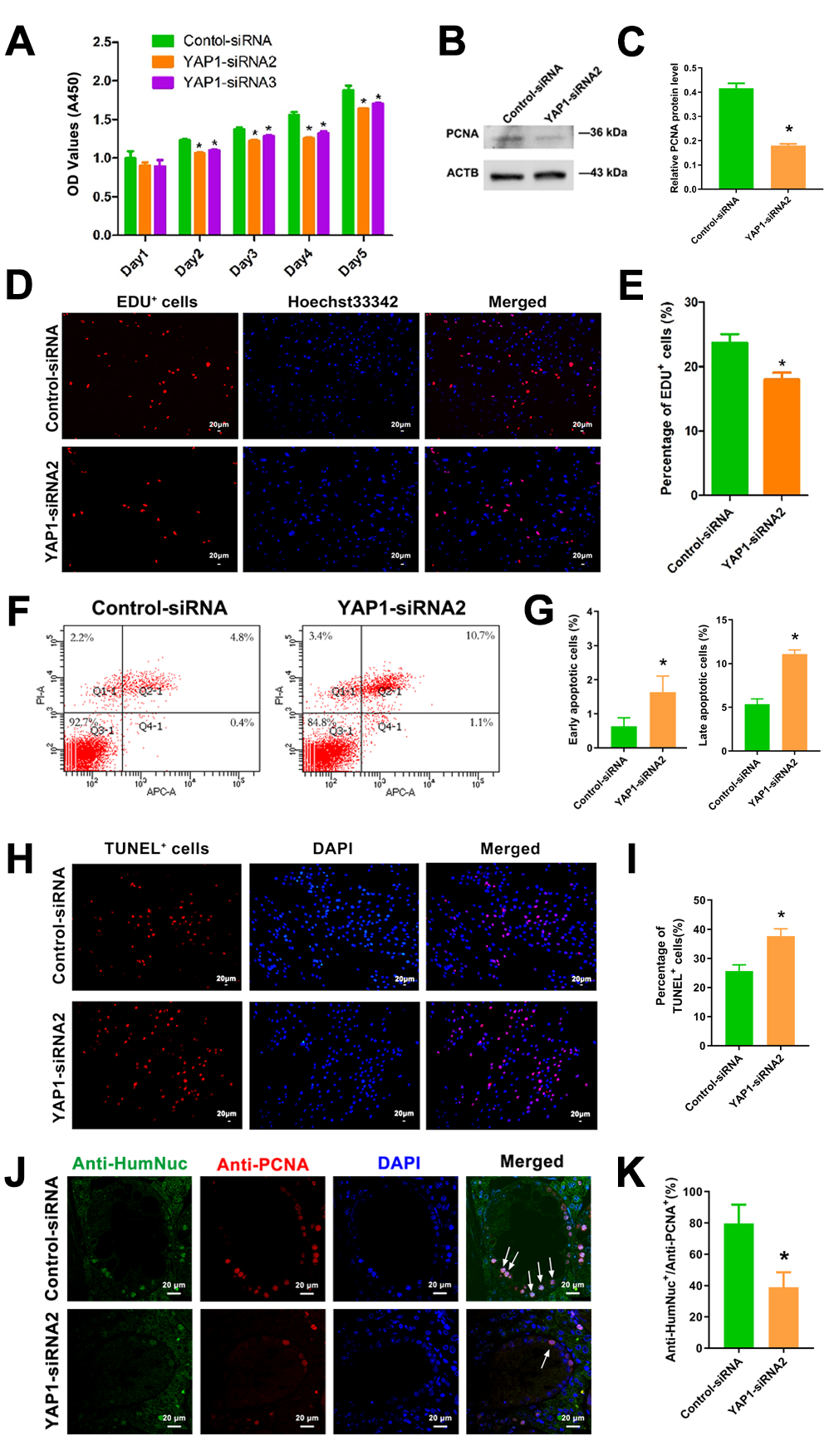
图2. YAP1敲低对人精原干细胞生物学功能的影响
通过RNA测序和免疫共沉淀结合质谱分析(Co-IP-MS)发现,YAP1可通过与转录因子RAD21相互作用,靶向NEDD4调控人精原干细胞的命运。采用Co-IP、双荧光素酶基因报告实验等技术论证YAP1、RAD21及NEDD4三者的相互关系(图3)。
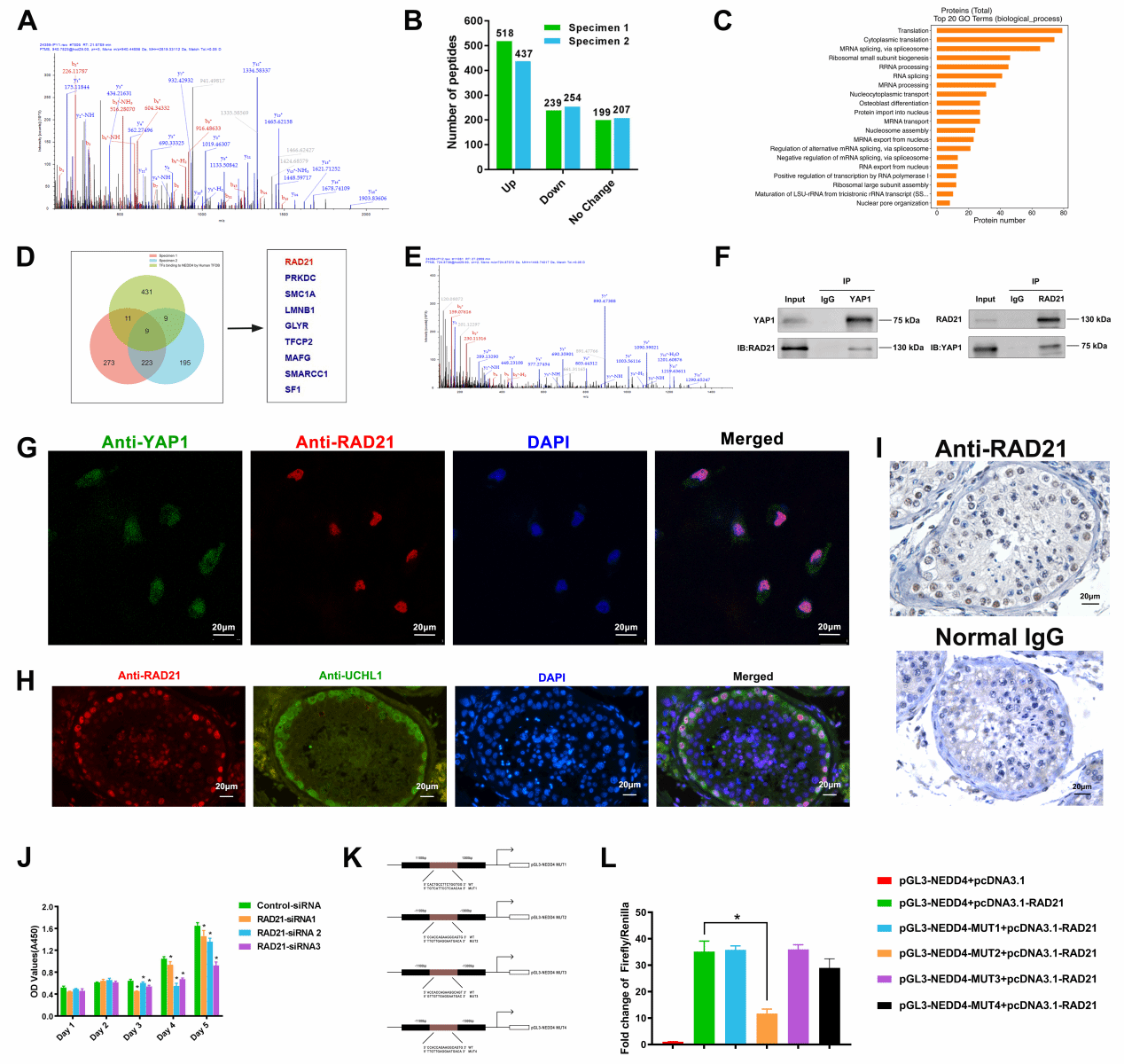
图3. YAP1、RAD21及NEDD4在人精原干细胞中存在相互作用
功能研究表明,YAP1下游靶基因NEDD4可促进人精原干细胞系的增殖和DNA合成,抑制其凋亡(图4)。
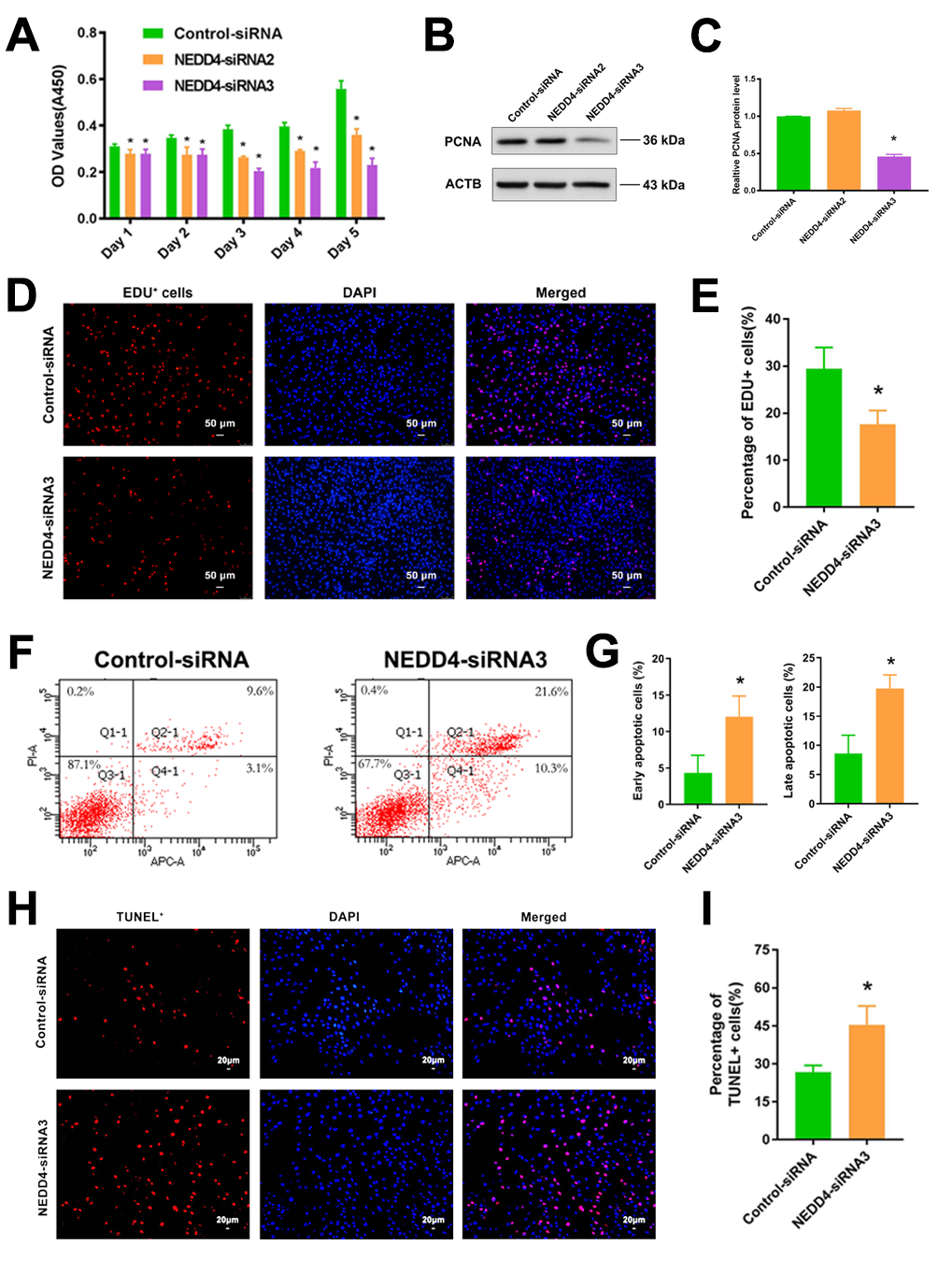
图4. NEDD4敲低对人精原干细胞生物学功能的影响
为进一步论证YAP1在体内水平对精原干细胞命运的影响,研究者构建了雄性生殖细胞Yap1特异性。敲除(Yap1 cKO)小鼠,雄性生殖细胞YAP1特异性敲除可导致小鼠生精障碍。组织免疫荧光显示,Yap1 cKO小鼠睾丸生精小管内精原干细胞标记物UCHL1、未分化精原干细胞标记物PLZF、已分化精原细胞标记物c-Kit及增殖细胞核抗原PCNA阳性数量减少;TUNEL染色显示,Yap1 cKO小鼠睾丸组织切片中TUNEL阳性生殖细胞数量增多(图5)。

图5. 雄性生殖细胞Yap1条件性敲除对精原干细胞自我更新和生殖细胞凋亡的影响
有趣的是,该团队发现Yap1 cKO小鼠呈现出少弱畸形症(图6)。
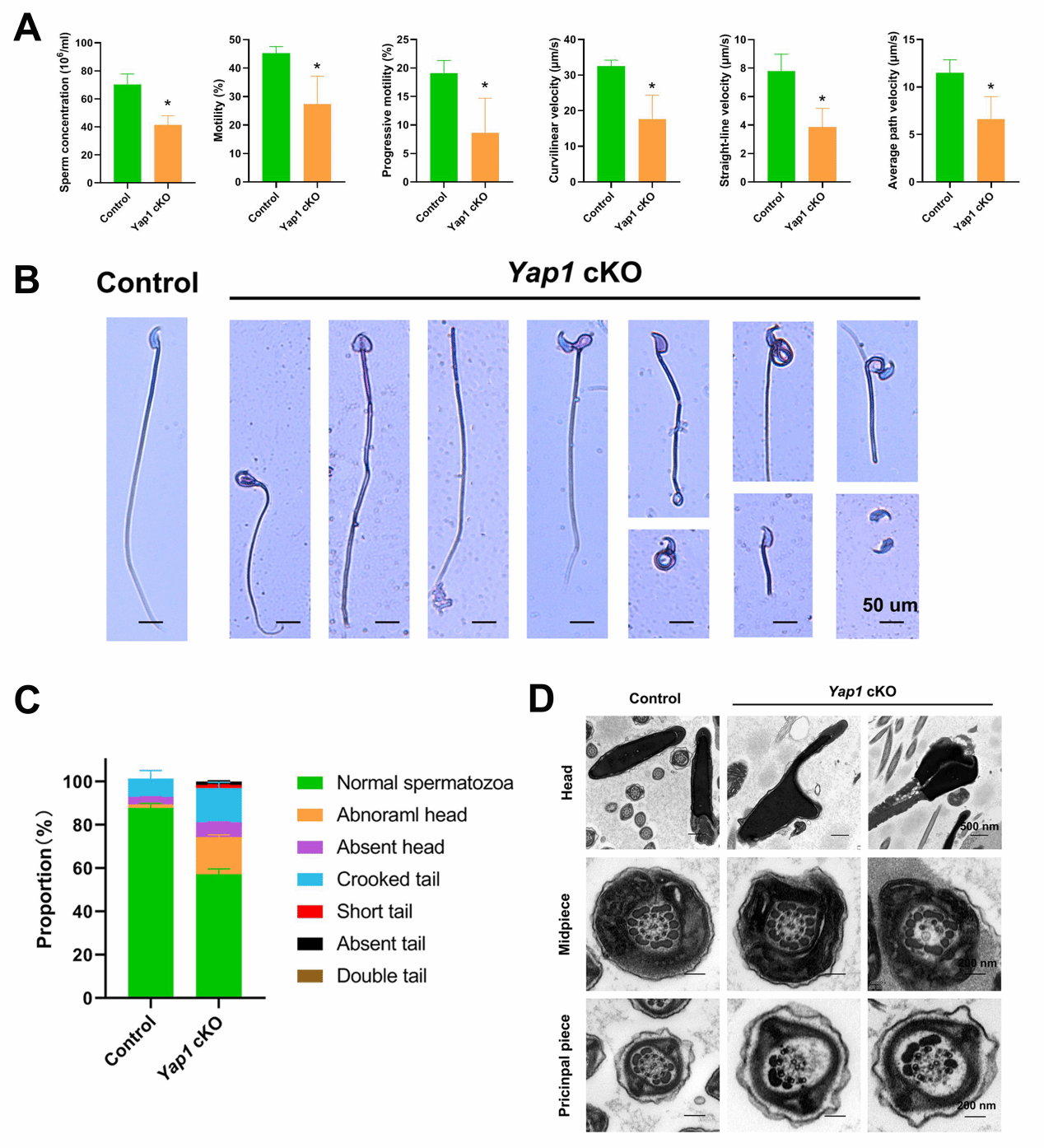
图6. 雄性生殖细胞Yap1条件性敲除对精子发生的影响
在本研究中,该团队发现YAP1/RAD21/NEDD4对人精原干细胞命运的重要调控作用,并揭示YAP1基因SNVs或低表达与非梗阻性无精子症的相关性。YAP1蛋白质是一个高度保守的蛋白,有可能作为精子发生障碍的标记物或治疗靶点。本研究为人类精子发生的遗传调控机制提供了新的见解,并为男性不育的诊治提供了新的靶点。
原文链接:DOI: 10.34133/research.0544
通讯作者:

何祖平 教授
(海南省医学科学院 PI)
何祖平,博士,二级教授,海南医科大学C类人才,海南省医学科学院PI,博士生导师。入选上海高校特聘教授(东方学者)、湖湘高层次人才聚集工程-杰出创新人才、上海市浦江人才计划。历任美国乔治城大学助理教授,上海交通大学研究员(三级技术岗位)、博士生导师、上海市男科学研究所所长,湖南师范大学医学院院长、二级教授、“潇湘学者”特聘教授、博士生导师。主持国家自然科学基金重点项目、国家重点研发计划课题、国家重大科学研究课题(2项)、国家自然科学基金面上项目(5项)等科研项目12项。长期从事生殖干细胞的遗传与表观遗传机制及其临床转化应用研究。其研究成果发表在国际著名期刊,如Cell Death & Differentiation、Research、Cell Death & Disease等。他以通讯作者或第一作者已发表SCI收录论文93篇,获得湖南省自然科学奖二等奖。


