11月3日,海南医科大学生命科学与医学技术学院毕洪凯教授团队联合上海交通大学、美国伊利诺伊大学香槟分校等单位,在国际权威学术期刊《PNAS》(美国国家科学院院刊)上在线发表题为“Switching the strict substrate specificities of the β-ketoacyl-acyl carrier protein synthases,FabH and BioZ”(β-酮脂酰-酰基载体蛋白合成酶FabH和BioZ底物特异性的互换)的研究论文。

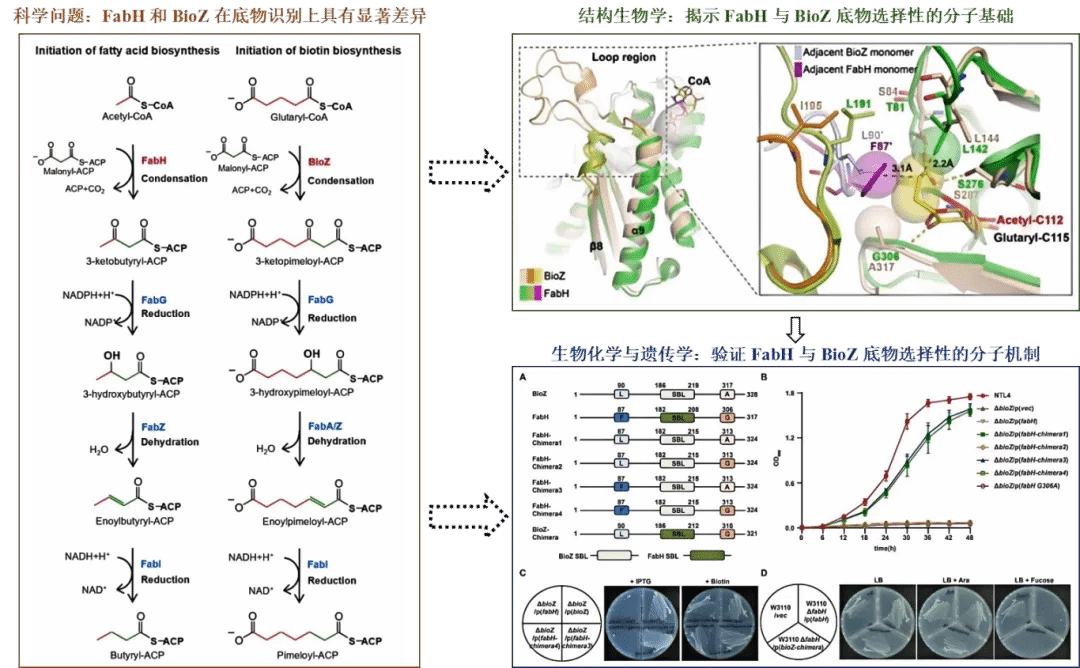
β-酮酰-酰基载体蛋白(ACP)合成酶是碳链延伸过程中的关键酶,能够催化酰基-CoA或酰基-ACP与丙二酰-ACP缩合生成β-酮酰-ACP。其中,两个同源酶FabH(β-酮酰基-ACP合酶III)与新近鉴定的BioZ分别负责启动细菌脂肪酸和生物素的生物合成途径。FabH主要利用乙酰-CoA作为引物底物,而BioZ则特异性识别带有带电ω-羧基的较长底物—戊二酰-CoA。尽管两者催化机制相似,但其严格底物特异性的分子机制尚不明确。
本研究创新性地解析了根瘤农杆菌BioZ与戊二酰-CoA结合的两种高分辨率晶体结构(AtBioZ(glutaryl-C115):CoA复合物和AtBioZ (C115S):glutaryl-CoA复合物),明确了底物结合的关键结构区域。通过结构引导的定点突变策略,将BioZ的β8-α9环和Ala317残基引入大肠杆菌FabH中,成功将FabH的底物偏好从乙酰-CoA转变为戊二酰-CoA,构建出具有BioZ功能的嵌合酶;反之,将FabH相应结构元件移植到BioZ中,则使BioZ获得FabH活性。体外酶学实验与等温滴定量热分析进一步证实,嵌合酶虽催化效率略低于天然酶,但其底物结合特异性已实现完全转换。
本研究综合运用生物化学、遗传学及结构生物学等方法,首次揭示了FabH与BioZ底物选择性的分子机制,为理解酶的结构与功能关系提供了新视角。该成果不仅从原子层面深化了我们对细菌脂肪酸与生物素合成机制的认识,也为酶的理性设计与功能进化研究提供了新思路,同时为针对该类酶的抗菌药物开发及生物合成催化剂设计奠定了重要基础,对感染性疾病治疗与合成生物学应用具有积极意义。
该成果以海南医科大学为第一完成单位。海南医科大学毕洪凯教授、上海交通大学张良教授及美国伊利诺伊大学香槟分校John Cronan教授为共同通讯作者;生命科学与医学技术学院博士后杭旭东、上海交通大学张琳副研究员及右江民族医学院黄衍强教授为共同第一作者。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2509301122
