近日,国际顶尖学术刊物《Cell》子刊——《Developmental Cell》以“Secreted PTEN binds PLXDC2 on macrophages to drive antitumor immunity and tumor suppression”为题报道了我校陈国强院士与上海交通大学医学院肿瘤系统医学全国重点实验室沈少明研究员、张铖博士的合作研究成果。该研究揭示了PTEN可通过非经典蛋白分泌通路分泌到细胞外,并通过重编程肿瘤微环境中的巨噬细胞,实现抗肿瘤免疫的激活与肿瘤抑制。评审人高度评价该成果,指出该项研究“在揭示PTEN在动态肿瘤微环境中的复杂作用方面迈出了重要的一步,特别是它在癌症免疫治疗的应用。值得注意的是,这项研究揭示了PTEN和PLXDC2之间的一种全新的相互作用,阐明了以前未被挖掘的肿瘤内免疫调节机制。此外,该研究还显示PTEN能够加强抗PD -1治疗效应,强调了其临床应用前景。

PTEN作为肿瘤中最常失活的肿瘤抑制因子之一,其功能丧失导致多种肿瘤的发生与恶性进展。虽然目前多项研究表明,PTEN的缺失或突变可促使多种类型的肿瘤呈现免疫抑制状态,加剧肿瘤的恶性进程。然而,PTEN调节肿瘤免疫微环境的机制,特别是PTEN是否能够直接影响肿瘤免疫微环境,仍不清楚。
近十年来,陈国强及其团队一直致力于PTEN的研究,在PTEN的翻译后修饰、核PTEN和PTEN变异体的功能研究方面取得系列成果,在Nature Cell Biology(2019;21:1436-1448), Nature Communication (2012;3:911; 2018;9:2392; 2020;11:1720; 2022;13:2762), Blood(2010;116:2579-2581), Leukemia(2017;31:2260-2264),Oncogene (2022;41:4877-4892)和EMBO report(2015;16:1563-80)等发表系列论文。在这些研究过程中,他们意外地发现各种细胞系的培养上清液中存在PTEN蛋白,并通过系列实验证实,跨膜emp24结构域蛋白10(TMED10)识别PTEN蛋白的274位的色氨酸(W274),介导PTEN分泌到细胞外。在C57BL/6J小鼠皮下接种B16-F10小鼠黑色素瘤的间质液(TIF)中存在大约22 ng/ml的PTEN,并证实这些PTEN主要来源于肿瘤细胞,确认分泌的PTEN发挥肿瘤抑制作用。
在此基础上,研究者利用多种肿瘤模型发现分泌的PTEN能够显著抑制肿瘤生长,且不依赖于其经典的磷酸酶功能。尤其是,他们直接瘤内注射体外重组的PTEN蛋白,发现瘤内注射PTEN的半衰期约为7小时,并表现出剂量依赖性的肿瘤抑制作用。进一步研究发现分泌PTEN的肿瘤抑制功能依赖于肿瘤免疫微环境中的肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs),和导致TAMs从免疫抑制表型(M2)重编程为促炎表型(M1)。重编程的TAMs增强肿瘤微环境中的CD8+ T细胞与NK细胞的抗肿瘤功能,实现对肿瘤的抑制。
为了了解PTEN导致巨噬细胞极化的分子机制,他们从包含1920个跨膜蛋白文库中,筛选到一个在巨噬细胞表面特异性表达的候选基因PLXDC2。进一步的系列体外实验和骨髓特异性的Plxdc2缺失小鼠证实PLXDC2属于PTEN受体。细胞外PTEN通过结合巨噬细胞表面的PLXDC2,激活JAK2-STAT1信号通路,进而介导巨噬细胞的抗肿瘤免疫并抑制肿瘤生长。M2样TAMs已被证明可以对各种治疗药物产生治疗耐药性,包括阻断PD-1的免疫治疗。为此,他们发现PTEN或PD-1抗体单药治疗均可减少多种肿瘤的大小,而联合PTEN/抗PD-1治疗效果最为显著。值得注意的是,PD-1阻断并不影响TIFs、淋巴结或血液中的细胞外PTEN的水平,但PTEN治疗提高了体内抗PD-1治疗的疗效。
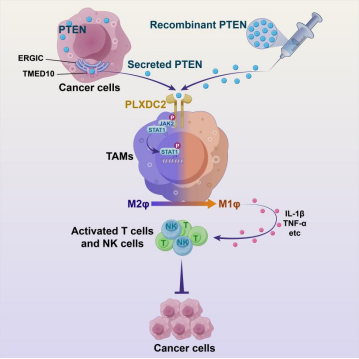
综上所述,该研究发现PTEN发挥细胞因子样作用。它通过非经典分泌通路分泌至细胞外,通过与肿瘤免疫微环境中的巨噬细胞表面PLXDC2结合,经PTEN-PLXDC2-JAK2-STAT1轴线重编程肿瘤免疫微环境,抑制肿瘤进展。该研究在揭示了PTEN影响肿瘤免疫微环境的新机制的同时,为靶向PTEN的肿瘤治疗提供了重要理论基础。
上海交通大学医学院附属仁济医院博士后张铖,博士研究生马鸿明、沈嘉明和助理研究员武帅为该研究论文共同第一作者,陈国强院士和上海交通大学医学院附属仁济医院衰老与组织修复研究院沈少明研究员为共同通讯作者。该工作得到国家自然科学基金和国家重大研究计划的支持。
原文链接:
https://www.sciencedirect.com/science/article/pii/S1534580724004866
