7月29日,我校生命科学与医学技术学院毕洪凯团队的原创性研究论文“2-oxoglutarate:acceptor oxidoreductase-catalyzed redox cycling effectively targets coccoid forms of Helicobacter pylori(2-氧戊二酸:受体氧化还原酶催化的氧化还原循环有效靶向幽门螺杆菌球形体)”在国际权威学术刊物《Nature Communications(自然·通讯)》正式发表。

幽门螺杆菌(Helicobacter pylori,Hp)作为全球性重要病原体,在慢性胃炎、消化性溃疡乃至胃癌等多种胃部疾病中发挥着核心致病作用。传统的四联疗法因Hp耐药性加剧面临严峻挑战,而Hp在特定环境压力下发生的球形变(螺旋杆状转变为球形的一种适应性生存状态),更容易导致治疗失败或复发。本研究聚焦含1,4-萘醌骨架的Napabucasin(NPB),首次探索其抗Hp活性,发现其对耐药螺旋形、球形及生物膜内Hp均有强效杀菌作用,最小抑菌浓度MIC50/90值低至0.016/0.031μg/mL,体内外抗Hp效果显著优于常规疗法,且对肠道菌群影响小、耐药频率极低。
靶点机制研究发现,NPB通过靶向α-酮戊二酸氧化还原酶(OOR),被其识别激活后,经氧化还原循环持续产生活性氧(ROS),杀菌浓度水平的ROS超出Hp抗氧化系统修复能力,最终导致菌体死亡。冷冻电镜解析和体内外实验验证,OorD亚基的Leu44和Lys46是OOR识别和代谢NPB的关键位点,突变后NPB活性显著下降。
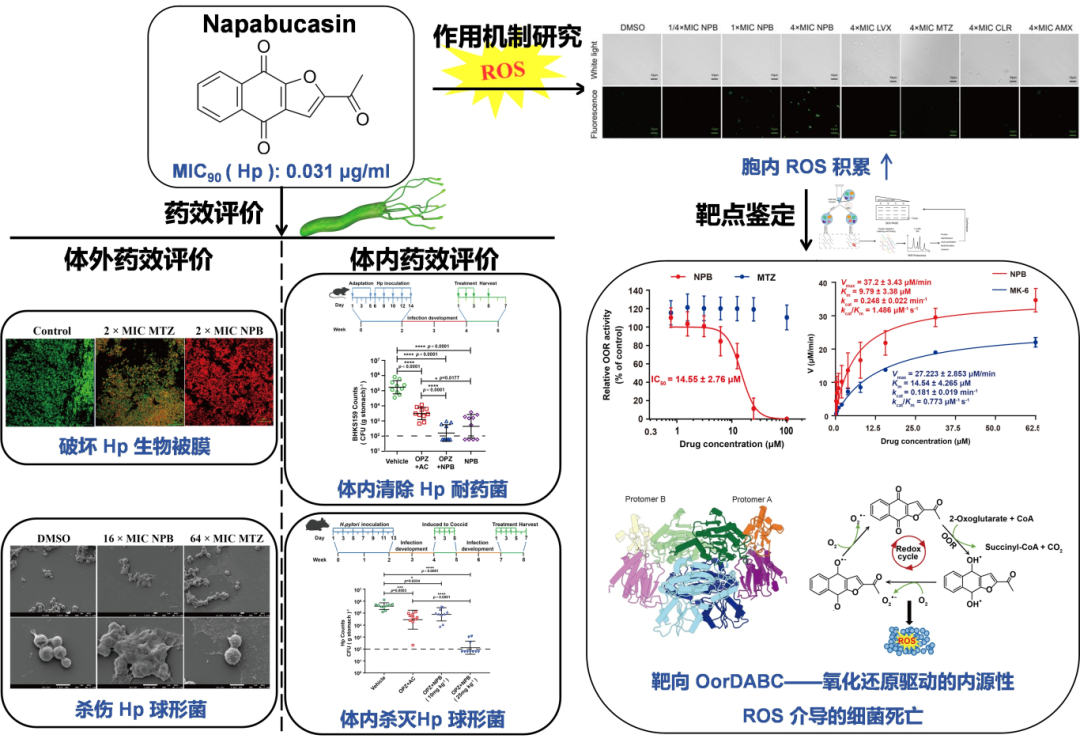
本研究创新性地提出靶向OOR驱动ROS生成的全新抗菌路径,将临床III期抗肿瘤药物NPB重定位至抗Hp领域,并突破球形Hp清除的临床难题。这为研发难治性Hp感染的新型药物奠定了理论基础,有望填补现有疗法空白,对降低胃癌等肿瘤风险具有重要意义。
该成果以海南医科大学为第一完成单位,生命科学与医学技术学院博士后杭旭东和黄虹铭、上海科技大学兰伟萁博士和右江民族医学院黄衍强教授为该论文的共同第一作者,毕洪凯教授和上海科技大学高岩研究员为通讯作者。
点击查看原文链接
