
海南医科大学/海南省医学科学院的杨献文研究员团队多年来专注于深海真菌天然产物研究(J. Med. Chem. 2024, 67, 7504-7515; Org. Lett. 2024, 26, 5695-5699; Org. Lett. 2024, 26, 3889-3895; Chin. Chem. Lett. 2024, 35, 109723; Chin. J. Chem. 2024, 42, 3283-3292; Chin. Chem. Lett. 2022, 33, 2057-2059)。近期,该团队与厦门大学许韧教授课题组合作,从该团队构建的海洋微生物天然化合物库(CoLMM)中选择251个深海真菌来源的化合物进行活性测试,发现喹啉酮生物碱viridicatol(VDC)可通过靶向Wnt/SHN3信号通路显著促进成骨分化,有效缓解骨质疏松,加速骨折愈合并改善成骨不全症。相关成果以“Viridicatol from the Deep-Sea-Derived Fungus Alleviates Bone Loss by Targeting the Wnt/SHN3 Pathway”为题发表在4月7日的Advanced Science上。该发现创新性构建了“海洋药物-骨靶向递送-遗传性骨病干预”的全链条解决方案,为骨质疏松、骨折修复及成骨不全症的治疗提供了全新范式。
深海探药:破解骨代谢“开关”密码
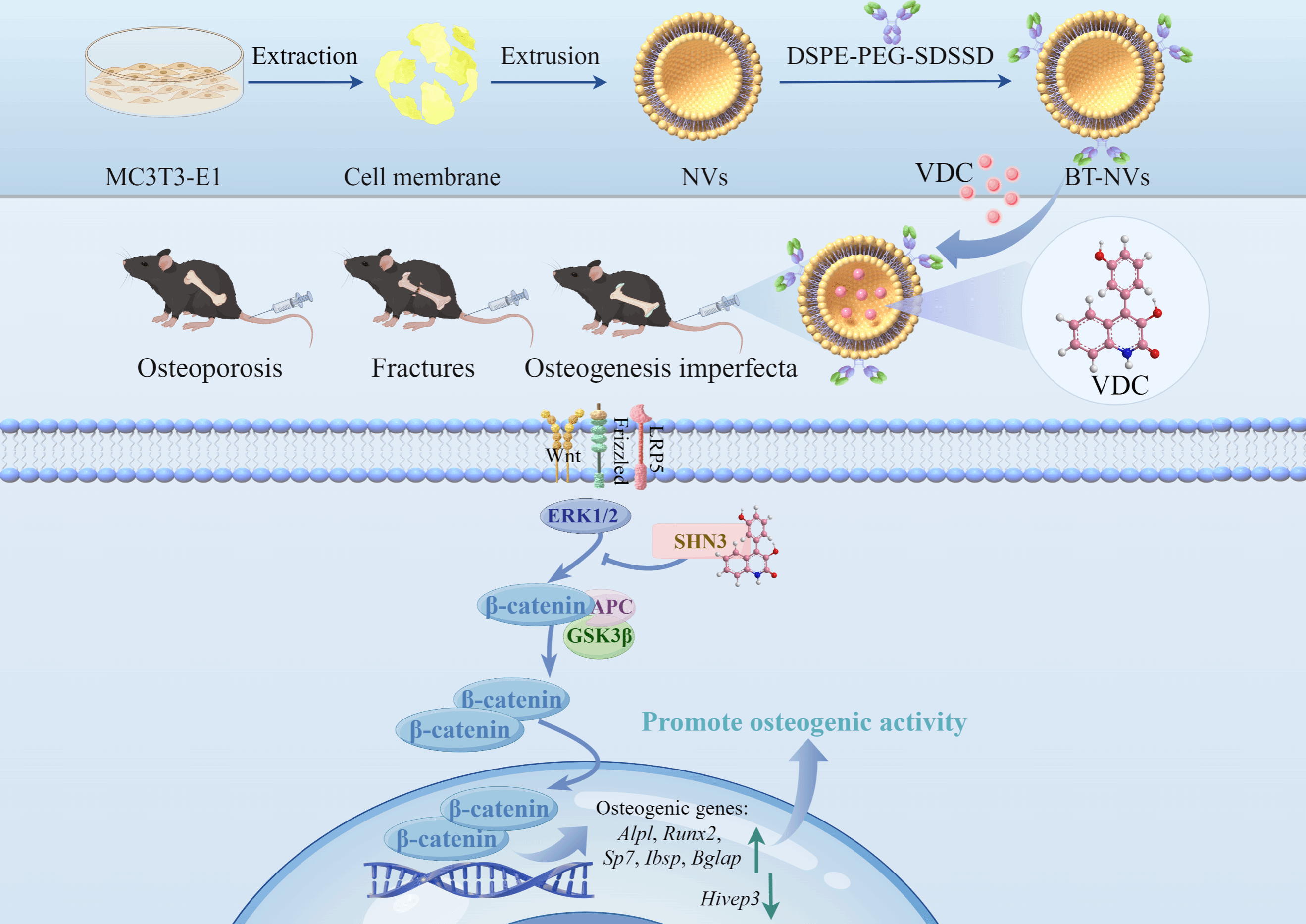
Schnurri-3(SHN3)是调控骨合成代谢“开关”靶点,短期抑制 SHN3 可显著增强成骨细胞活性、提升骨量。然而,目前尚无靶向SHN3发挥治疗作用的化合物。团队通过独创的“ALP活性表型/SHN3基因调控”双维度筛选体系,对CoLMM中的251个深海天然化合物进行活性测试,发现viridicatol(VDC)能高效促进小鼠骨髓间充质干细胞(BMSCs)及颅盖骨成骨细胞系MC3T3-E1的矿化能力,显著增强成骨分化。进一步机制研究表明,VDC通过结合SHN3蛋白,激活Wnt信号通路下游GSK-3β和ERK的磷酸化,促使β-连环蛋白积累,进而上调成骨标志基因(Alpl、Runx2、Ibsp、Bglap、SP7)表达,最终驱动成骨分化进程。在卵巢切除(OVX)诱导的骨质疏松小鼠模型中,VDC治疗显著提升骨密度并修复骨微结构;同时,在骨折模型中,VDC表现出加速骨痂形成和愈合的潜力。
技术突破:骨靶向递送治疗新策略
针对严重成骨不全(Col1a2oim/oim模型)的复杂骨病,团队创新性将海洋天然化合物与生物纳米技术结合,研发骨靶向纳米囊泡(BT-NVs)递送系统,通过骨靶向肽SDSSD偶联的成骨细胞膜生物纳米囊泡特异性识别骨组织,实现VDC的高效靶向递送,显著缓解成骨不全的骨丢失,为复杂骨病的精准治疗提供了新策略。
该成果以海南医科大学为第一单位,海南医科大学基础医学与生命科学学院谢春兰副研究员为第一作者,厦门大学叶商辉博士和乐昱廷硕士为共同第一作者。杨献文研究员、许韧教授和李娜助理研究员为共同通讯作者。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202416140


